Миокардиты
Миокардит - поражение сердечной мышцы преимущественно воспалительного характера, обусловленное непосредственным или опосредованным через иммунные механизмы воздействием инфекции, паразитарной и протозойной инвазии, химических и физических факторов, а также поражение, возникающее при аллергических и аутоиммунных заболеваниях.
Абсолютная частота миокардитов неизвестна, можно ориентироваться только на данные частоты встречаемости этого осложнения при различных заболеваниях. При дифтерии миокардит встречается у 20-30% пациентов, а летальность у больных дифтерией от кардиальных осложнений достигает 50-60%. У больных острыми респираторными вирусными заболеваниями миокардит диагностируется в 1-15% случаев.
В период эпидемии гриппа клинические и инструментальные признаки миокардита обнаруживаются у 1-5% больных. ЕСНО-вирусы поражают миокард в среднем в 5% случаев, а энтеровирусы - в 5-15%. По данным ВОЗ в 1982-1996 гг., стабильное поражение сердечной мышцы при заражении вирусами Коксаки группы А развивалось в 3% случаев, при гриппе А - в 1,4% случаев, при гриппе В - в 1,2%, при парагриппе - в 1,7% и при аденовирусных инфекциях - в 1% случаев.
При хронических инфекционных заболеваниях клинико-инструмен-тальные признаки воспалительного поражения сердца выявляются у 10-30% больных. При гепатите В миокардит отмечается у 5-15% больных, при клещевом Лайм-боррелиозе - у 15-20%, при токсоплазмозе - у 10-20%, при системном хламидиозе - у 5-20%. У ВИЧ-инфицированных поражение миокарда встречается в 20-40% случаев.
В ряде случаев миокардит возникает вследствие перекрестных аутоиммунных реакций. Иммунный (аутоиммунный) миокардит может быть либо самостоятельным заболеванием, либо одним из синдромов при системных заболеваниях соединительной ткани или аллергических реакциях замедленного типа (реакция отторжения трансплантата, синдром Лайела, ожоговая болезнь).
При ревматоидном артрите поражение сердца выявляется у 5-25% больных, при системной склеродермии - у 20-40%, при системной красной волчанке - у 5-15% пациентов. При ожоговой болезни признаки миокардита выявляются в 20-40% случаев. Миокардит может быть вызван воздействием на сердечную мышцу токсических веществ или физических факторов (например кардиотоксин - при дифтерии, ионизирующее излучение - при лучевой терапии опухолей средостеия).
По данным патологианатомических исследований, признаки воспалительния миокарда обнаруживают в 4-9% аутопсий. Средний возраст заболевших составляет 30-40 лет. Женщины заболевают миокардитом несколько чаще мужчин, но у мужчин чаще встречаются тяжелые формы заболевания. Несмотря на то что миокардит был выделен в качестве самостоятельного заболеванря более 200 лет назад, до сих не решены вопросы этиологии, патогенеза, клинической диагностики и специфического лечения этого заболевания.
Что провоцирует / Причины Миокардит:
Причины миокардитов весьма разнообразны (таблица 26). Наиболее частыми из них являются инфекции (вирусные, бактериальные, риккетсиозные, спирохетозные, паразитарные, грибковые), которые служат причиной так называемых инфекционных или инфекционно-токсических миокардитов. Вызвать миокардит может практически любой инфекционный агент, однако более чем в половине случаев возбудителями миокардитов являются вирусы, в первую очередь, энтеровирусы Коксаки типа В. Важную роль в возникновении инфекционных миокардитов отводят также цитомегаловирусам, аденовирусам, вирусам гриппа, кори, краснухи, инфекционного мононуклеоза.
Наиболее известными из бактериальных инфекционно-токсических миокардитов являются дифтерийный и скарлатинозный миокардиты. Дифтерийный миокардит осложняет течение этого инфекционного заболевания в 10-25% и отличается очень тяжелым прогнозом (летальность - 50-60%). Вторая группа причин, вызывающих аллергические (иммунопатологические) миокардиты, объединяет различные заболевания и синдромы, в основе которых лежат аллергические или иммунопатологические реакции, в том числе на применение лекарственных препаратов, сывороток. Нередко аллергические (аутоиммунные) миокардиты развиваются при системных заболеваниях соединительной ткани, бронхиальной астме, синдроме Лайелла, ожогах, трансплантациях сердца.
К этой же группе причин миокардитов относятся иммунопатологические (аутоиммунные) процессы, которые развиваются в результате перенесенной в прошлом инфекции, вирусной инфекции Коксаки типа В. Как правило, на этой стадии заболевания присутствия вирусных частиц в кардиомиоцитах и интерстициальной ткани обнаружить не удается. Отсутствуют также внесердечные проявления инфекции.
В этих случаях основное значение в возникновении воспаления сердечной мышцы имеет клеточный и гуморальный иммунный ответ, “запущенный” инфекционным агентом, при котором миокард инфильтрируется Т-лимфоцитами, IgG, аутоиммунными антителами, комплементом и другими агрессивными иммунными факторами, повреждающими кардиомиоциты. В этих случаях речь может идти об инфекционно-аллергических миокардитах, которые нередко представляют собой лишь дальнейшую стадию повреждения сердечной мышцы инфекционным агентом.
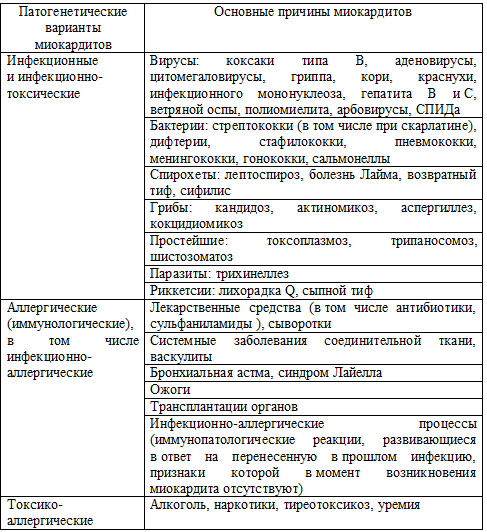
Таблица 26. Основные причины миокардитов
К третьей группе причин миокардитов относятся заболевания и патологические состояния, для которых типично прямое токсическое воздействие на миокард различных химических и биологически активных веществ (тиреотоксикоз, уремия, алкоголь), вызывающее иммунное воспаление сердечной мышцы с признаками реакции гиперчувствительности замедленного типа. Миокардиты, обусловленные этими причинами, принято называть токсико-аллергическими миокардитами.
ЭТИОЛОГИЧЕСКИЕ ВАРИАНТЫ МИОКАРДИТОВ
Вирусный миокардит
Вирус Коксаки В является РНК-содержащим вирусом - одним из представителей группы энтеровирусов. Вирусный (Коксаки В) миокардит является наиболее частой этиологической формой миокардитов, и это должно обязательно учитываться при диагностике. Кроме того, вирус Коксаки В является также ведущей причиной острых миоперикардитов. Для вируса Коксаки В типична высокая кардиотропность. Современные методы исследования позволяют обнаружить его в кардиомиоцитах, в перикарде, в клапанах сердца.
Вирус Коксаки В может вызвать развитие миокардита в любом возрасте, хотя, как указывалось ранее, чаще болеют лица среднего и молодого возраста. Миокардит, вызванный вирусом Коксаки, часто развивается у лиц в возрасте старше 50 лет. Этот миокардит может развиться и у людей, страдающих ишемической болезнью сердца, что, конечно, затрудняет диагностику. Около 60% страдающих Коксаки-миокардитом и миоперикардитом составляют мужчины. У женщин заболеваемость Коксаки-миокардитом чаще наблюдается во время беременности и в послеродовом периоде. При поражении вирусом Коксаки во время беременности миокардит может развиваться у плода и быть причиной мертворождения. В силу указанных причин возможно развитие миокардита у новорожденных, а также в первые 6 месяцев жизни.
Для Коксаки-миокардита характерна сезонность. Заболевание чаще развивается летом и осенью, по данным Karjalainen (1984), наиболее высокая заболеваемость отмечается в мае, ноябре, декабре. Клиническая картина вирусного (Коксаки В) миокардита в целом соответствует описанию симптоматики миокардита, сделанному нами ранее. Следует только отметить, что перед развитием кардиальной симптоматики у большинства больных отмечается лихорадка и синдром гастроэнтерита (неинтенсивные боли в эпигастрии, возле пупка, тошнота, рвота, нечастый, обильный водянистый стул без патологических примесей). В клинической картине Коксаки В миокардита наряду с симптомами миокардита часто присутствуют плевродиния (боль, обусловленная вовлечением в патологический процесс плевры, усиливающаяся при дыхании и кашле), лимфаде-нопатия, спленомегалия, орхит.
Установлены особенности течения Коксаки-миокардита в зависимости от возраста. У молодых людей в возрасте 16-20 лет миокардит протекает с выраженной клинической симптоматикой, часто с присоединением перикардита или плеврита, течение миокардита острое, как правило, заканчивается выздоровлением. У лиц в возрасте старше 40 лет симптоматика миокардита развертывается более постепенно, отчетливо доминирует выраженная кардиалгия, которая может сохраняться длительное время (заболевание часто принимается за ИБС). Могут наблюдаться одышка и сердцебиения.
При диагностике вирусной (Коксаки В) этиологии миокардита необходимо учитывать: наличие симптоматики острого гастроэнтерита в периоде, предшествующем развитию клиники миокардита, не менее, чем четырехкратное нарастание титров специфических вируснейтрализующих антител в парных сыворотках кровибольного, обнаружение вируса или вирусного антигена в фекалиях больного с помощью электронной микроскопии, иммуноэлектроос-мофореза, выделение вируса в культуре клеток из различных биологических субстратов (смывы из зева, фекалии), определение РНК вируса Коксаки в крови больного и в био-птатах миокарда методом полимеразной цепной реакции. У большинства больных Коксаки В миокардит протекает благоприятно, больные выздоравливают в течение нескольких недель, однако иногда наблюдается развитие дилатационной кардиомиопатии, возможны летальные исходы.
Септический миокардит
Септический миокардит - это бактериальный миокардит, развивающийся при сепсисе и характеризующийся внедрением инфекционного агента в миокард. На долю септического миокардита в современных условиях, при лечении сепсиса высокоактивными антибиотиками, приходится около 1,5-4% всех миокардитов. Основными возбудителями септического миокардита являются стафилококки, синегнойная палочка, кишечная палочка, сочетание этих видов флоры.
Патоморфологическая картина септического миокардита достаточно характерна. При макроскопическом исследовании сердце увеличено в размерах, имеет «дряблый», «вареный» вид, в толще миокарда могут быть очаги кровоизлияний. При микроскопическом исследовании обнаруживаются значительный интерстициаль-ный отек миокарда, тромбоцитарные и эритроцитарные микроагрегаты в микроциркуляторном русле, а также множественные клеточные инфильтраты в миокарде, состоящие из нейтрофилов, гистиоцитов, лимфоцитов (в инфильтратах четкое преобладание нейтрофилов). В кардиомиоцитах определяется дистрофия (белковая, вакуольная), миолиз, расщепление миофибрилл (возможен диско-идный распад). Характерно также обнаружение в миокарде микроорганизмов. Особенно большие участки миолиза кардиомиоцитов наблюдаются при синегнойном сепсисе.
Септический миокардит всегда протекает с выраженной клинической картиной, обычно речь идет о тяжелой форме миокардита, и он может быть непосредственной причиной смерти больных сепсисом. Симптоматика септического миокардита соответствует вышеописанным проявлениям. Однако, по мнению профессора Палеева Н.Р. для септического миокардита в отличие от вирусного характерна выраженная тахикардия, при этом наблюдается несоответствие между частотой сердечных сокращений и температурой тела, могут отмечаться мерцательная аритмия и пароксизмальная тахикардия.
Выраженная тахикардия при септическом миокардите объясняется активацией симпатического отдела вегетативной нервной системы, системы цитокинов, стимуляцией синтеза провоспалительных медиаторов. Одновременно наблюдается низкое периферическое сосудистое сопротивление в результате системного раскрытия артериовенозных шунтов, которые активно функционируют при бактериемии.
На определенном этапе развития сепсиса у больных регистрируется гиперкинетический тип гемодинамики с высоким сердечным выбросом. В последующем, по мере генерализации воспалительного процесса, происходит резкое снижение насосной функции сердца, сердечный выброс становится низким, системный кровоток уже не может компенсироваться за счет выраженной тахикардии. Отражением этой ситуации является развитие выраженной сердечной недостаточности.
Диагностика септического миокардита осуществляется на основании вышеизложенных критериев диагностики миокардита и, конечно, учитывается наличие у больного сепсиса. Согласно решению Чикагской международной согласительной конференции (1991), сепсисом принято называть состояние, при котором наблюдается не менее двух признаков синдрома системного воспалительного ответа при наличии инфекционного очага (выявляемого клинически или подтвержденного бактериологически, но не обязательно с наличием бактериемии).
Синдром системного воспалительного ответа - неспецифическая генерализованная реакция на инфекционный процесс. Синдром системного воспалительного ответа констатируется при наличии двух или более следующих клинических симптомов: температура тела выше 380С или ниже 36°С; частота сердечных сокращений выше 90; частота дыхания выше 20 или рСО2ниже 32 мм рт. ст. (для больных на ИВЛ); количество лейкоцитов в периферической крови выше 12 х 109/л или ниже 4 х 109/л или незрелые формы лейкоцитов > 10%.
Миокардит при инфекционном эндокардите
Инфекционный эндокардит часто сопровождается развитием миокардита. Патологоанатомические и клинические проявления миокардита при инфекционном эндокардите те же, что при септическом миокардите, подробнее смотри в главе «Инфекционный эндокардит».
Дифтерийный миокардит
Дифтерия осложняется миокардитом в 6-8% случаев, а при тяжелом течении заболевания миокардит наблюдается почти у половины больных. Главным патогенетическим фактором дифтерийного миокардита является чрезвычайно высокая кардиотоксичность дифтерийного токсина и включение в патологический процесс аутоиммунного механизма, так как дифтерийный токсин вызывает выраженный распад кардиомиоцитов, компоненты которых становятся аутоан-тигенами. Кроме того, дифтерийный токсин сам является антигеном, причем существует определенное сходство антигена дифтерийного токсина с цитохромом ферментных систем кардиомиоцитов. Поэтому антитела к дифтерийному токсину блокируют цитохром кардиомиоцитов дополнительно к непосредственному ингибирующему влиянию токсина. В результате указанных процессов резко нарушается тканевое дыхание миокарда и образование в нем энергии и белка.
Патоморфологические изменения при дифтерийном миокардите очень выражены. При макроскопическом исследовании обращают на себя внимание серовато-желтый цвет миокарда, его дряблость, дилатация полостей сердца. При микроскопическом исследовании отмечаются распад кардиомиоцитов, жировая инфильтрация, резкое поражение сосудов микроциркуляторного русла (деструкция сосудистой стенки, гиперемия сосудов, повреждение эндотелия), множественные геморрагии в периваскулярной и межмышечной строме.
В межмышечной ткани выражен отек, выявляются клеточные инфильтраты, состоящие из гистиоцитов, лимфоцитов, плазмобластов, плазмоцидов, реже обнаруживаются нейтрофильные лейкоциты и эозинофилы. Наиболее пораженными оказываются стенки левого желудочка и папиллярные мышцы. Миокардит развивается обычно на 6-10 день от начала дифтерии, клиническая картина миокардита достигает максимальной выраженности к концу 2-3 недели, однако при молниеносной форме дифтерийный миокардит развивается чрезвычайно быстро и может в течение нескольких дней привести к смерти. Обычно миокардит развивается при средней степени тяжести и тяжелой дифтерии.
Характеризуя клиническое течение миокардита при дифтерии. Он всегда протекает тяжело, клиническая симптоматика его выражена, на первый план выступают признаки СН, синоаурикулярная и атриовентрикулярная блокады, нарушения внутрижелудочковой проводимости, синдром слабости синусового узла, экстрасистолическая аритмия, пароксизмальная тахикардия. Более благоприятно протекает миокардит, который развивается на 3-4 неделе от начала заболевания. В отдельных случаях дифтерийный миокардит протекает в течение нескольких недель и месяцев.
Миокардит при брюшном тифе
Поражение миокарда при брюшном тифе чаще характеризуется миокардиодистрофией, реже - миокардитом. Морфологический вариант миокардита, наиболее часто развивающийся при брюшном тифе - это интерстициальный, реже - гранулематозный миокардит. В развитии интерстициального миокардита принимают участие преимущественно лимфоциты и гистиоциты, наблюдается пролиферация и слущивание эндотелия сосудов микpоциркуляторного русла, отек интерстициальной ткани. Гранулематозный миокардит характеризуется глыбчатым распадом коллагеновых волокон и формированием вокруг очагов распада тифоидных узелков (гранулом) - очагов фибрина и скопления эпителиоидных клеток.
Миокардит развивается на 2-4-й неделе от начала заболевания, обычно при тяжелом его течении и при недостаточно эффективном лечении. Клиническая картина миокардита при брюшном тифе типичная, при этом редко наблюдаются мерцательная аритмия, полная атриовентрикулярная блокада, прогноз обычно благоприятный. Следует помнить о возможности развития послебрюшнотифозного миокардита через 1-2 недели после брюшного тифа.
Туберкулезный миокардит
Для туберкулеза наиболее характерно развитие хронического перикардита, миокардит развивается редко. Патоморфологические проявления миокардита зависят от формы туберкулеза. При первичном туберкулезе в миокарде обычно развивается узелковая, реже - диффузная макрофагальная реакция, формируются макрофагально-лимфоцитарные околососудистые гранулемы. При гематогенном туберкулезе в строме миокарда образуются туберкулезные бугорки, не содержащие сосудов, но имеющие участки творожистого некроза. При вторичном туберкулезе развивается интерстициальный миокардит. Клиническая картина туберкулезного миокардита характеризуется типичной симптоматикой, однако отличительной особенностью является значительное расширение не только левых, но и правых отделов сердца. Кроме того, туберкулезному миокардиту свойственно длительное и даже хроническое течение.
Миокардит при клостридиальной инфекции
При клостридиальной инфекции может наблюдаться множественное поражение органов, часто развивается миокардит. Поражение миокарда является следствием влияния на него клостридиального токсина. Типичным является обнаружение пузырьков газа в миокарде при патологоанатомическом исследовании, а также выраженных деструктивных изменений в миокардиальных волокнах, вместе с тем воспалительная инфильтрация обычно отсутствует. Clostridium perfringens может также вызвать формирование абсцессов в миокарде, перфорацию миокардиальной стенки и гнойный перикардит. Течение миокардита при клостридиальной инфекции тяжелое, прогноз неблагоприятен.
Миокардит при легионеллезе
Известно, что при легионеллезной инфекции (болезни легионеров) поражаются не только легкие, но и скелетная мускулатура (может отмечаться рабдомиолиз), почки (может развиться почечная недостаточность), печень, центральная нервная система, но поражение сердца считается не характерным или маловыраженным, проявляющимся только неспецифическими изменениями зубца Т, интервала ST. Однако иногда у больных развивается миокардит, в редких случаях с очагами некроза в миокарде, с застойной сердечной недостаточностью, возможно появление перикардиального выпота.
Миокардит при менингококковой инфекции
Миокардит может наблюдаться при менингококковой инфекции, но обычно при тяжелом течении менингита. Патоморфологические изменения в миокарде характеризуются воспалительными инфильтратами в интерстиции, состоящими из лимфоцитов, полиморфно-ядерных лейкоцитов, плазматических клеток, могут определяться миокардиальные некрозы. Менингококковый миокардит протекает типично, может приводить к развитию сердечной недостаточности. Возможно тяжелое течение миокардита с присоединением экссудативного перикардита и даже тампонады сердца. Менингококковый миокардит характеризуется также поражением проводящей системы сердца, атриовентрикулярного и синусового узлов, что может привести к внезапной смерти.
Миокардит при микоплазменной пневмонии
Клинически выраженный миокардит при пневмонии, вызванной микоплазмой, бывает редко. Чаще это миокардит, не проявляющийся клинически, но характеризующийся неспецифическими электрокардиографическими изменениями со стороны зубца Т и интервала ST, в редких случаях возможно развитие атриовентрикулярной блокады. Обычно электрокардиографические изменения исчезают через 1-2 недели. Причиной этих изменений считается аутоиммунный воспалительный процесс в миокарде. Однако возможно и тяжелое течение миокардита с развитием застойной сердечной недостаточности и присоединением экссудативного перикардита. У большинства больных наступает выздоровление, у некоторых пациентов возможно длительное течение миокардита с развитием сердечных аритмий.
Миокардит при пситтакозе
Миокардит при пситтакозе, вызванном Chlamydia psittaci, наблюдается довольно часто и характеризуется застойной сердечной недостаточностью и острым перикардитом. Возможно вовлечение в патологический процесс эндокарда, в этом случае развивается панкардит. Клиническая симптоматика поражения сердца включает лихорадку, кардиомегалию, застойную СН, артериальную гипотензию, ритм галопа, системные тромбоэмболии. Однако надо отметить, что лечение пситтакоза препаратами тетрациклинового ряда оказывается успешным и благоприятно влияет на течение миокардита.
Миокардит при сальмонеллезе
Клинически выраженный миокардит при сальмонеллезе наблюдается редко, обычно при тяжелом течении заболевания, преимущественно у детей, и ассоциируется с высокой смертностью. При тяжелой сальмонеллезной инфекции могут формироваться абсцессы в миокарде, которые могут разрываться и приводить к фатальной тампонаде сердца. Течение клинически выраженного миокардита обычно тяжелое, но развивается он постепенно, приводя к выраженной застойной сердечной недостаточности и тромбоэмболиям в сосуды большого и малого круга кровообращения. Все же у большинства больных миокардит протекает субклинически и проявляется преимущественно лишь неспецифическими изменениями зубца Т и интервала ST на электрокардиограмме.
Миокардит при болезни Уиппла
Болезнь Уиппла или кишечная липодистрофия - системное инфекционное заболевание тонкой кишки, вызываемое возбудителем Tropheryma whippelii, характеризующееся блокадой лимфатических сосудов тонкого кишечника, развитием синдрома экссудативной энтеропатии и нередко поражением других органов и систем. Заболевание развивается преимущественно у лиц со стойким угнетением Т-клеточного иммунитета. Возбудитель заболевания Tropheryma whippelii относится к некультивируемым грамотрицательным актиномицетам. Они обнаруживаются при электронной микроскопии внутри и вокруг макрофагов собственной пластинки слизистой оболочки тонкой кишки, в энтероцитах и макрофагах, в виде палочковидных образований размерами 0,3 х (1,5-2,5) мкм.
В основе заболевания лежит закупорка лимфатических сосудов тонкого кишечника PAS-положительными макрофагами. Основными симптомами заболевания являются боли в животе неопределенного характера, поносы, стеаторея, значительное снижение массы тела, синдром нарушенного всасывания, субфебрильная температура тела, полиартралгии, лимфаденопатия (увеличение забрюшинных и реже периферических лимфоузлов), полисерозит. Возможно появление геморрагии и узловатой эритемы на коже. У некоторых больных наблюдаются симптомы поражения нервной системы с парезом глазодвигательных мышц, атаксией, тремором.
Поражение миокарда наблюдается у 1/3 больных с болезнью Уиппла. В миокарде, а также в перикарде, створках клапанов обнаруживаются PAS-положительные макрофаги. Наблюдаются повреждения коронарных артерий с некрозами их гладкой мускулатуры. В миокарде могут обнаруживаться воспалительные инфильтраты и даже рубцовые изменения. Клинически миокардит при болезни Уиппла проявляется кардиомегалией, застойной сердечной недостаточностью, развитием аритмий сердца. В связи с фиброзом клапана аорты и митрального клапана появляется звуковая симптоматика их недостаточности.
Основным методом диагностики болезни Уиппла является гистологическое исследование биоптатов слизистой оболочки тонкой кишки, полученных во время фибродуоденоскопии. В биоптатах определяется инфильтрация собственной пластинки слизистой оболочки тонкой кишки крупными, пенистыми PAS-положительными макрофагами. Они обнаруживаются также в лимфатических узлах, биоптатах миокарда, печени, нервных стволов.
Миокардит при лептоспирозе Васильева-Вейля
При лептоспирозе Васильева-Вейля поражение миокарда чаще всего протекает субклинически, однако если при тяжелом течении лептоспироза развивается миокардит, то обычно он характеризуется очень выраженной симптоматикой и тяжелым течением. Выраженный миокардит при лептоспирозе характеризуется появлением мерцательной аритмии, атриовентрикулярной блокады I-II степени, возможно развитие сердечной недостаточности, перикардита. На электрокардиограмме обнаруживаются неспецифические изменения интервала ST и зубца Т. При патологоанатомическом исследовании сердца больных, погибших при фатальном течении лептоспироза, обнаруживаются обширные геморрагические инфильтраты в межуточной ткани миокарда, аорты, коронариит.
Миокардит при болезни Лайма
Болезнь Лайма - системный клещевой боррелиоз, природноочаговая трансмиссивная инфекционная болезнь, вызываемая Borrelia burgdorferi, и протекающая с распространенной кожной эритемой, лихорадкой, признаками поражения центральной и периферической нервной системы, сердца и крупных суставов. Название заболевания происходит от города Лайм в штате Коннектикут (США), в котором в 1982 г. Burgdorfer выделил из иксодова клеща возбудителя болезни, относящегося к спирохетам. Резервуаром обитания боррелий являются мелкие и крупные дикие (грызуны, сумчатые, олени, птицы) и некоторые домашние (кошки, собаки, овцы, крупный рогатый скот) животные, выделяющие возбудителя с мочой.
Переносчиком инфекции являются иксодовые клещи. Механизм заражения - трансмиссивный, через укус клеща. Распространенность заболевания совпадает с ареалом иксодовых клещей - северо-восточные и центральные регионы США, Китай, Япония, Австралия, Западная Сибирь, Дальний Восток. В месте укуса клеща возбудитель болезни проникает в кожу, вызывая развитие хронической мигрирующей эритемы, а также проникает в кровь и вместе с кровью распространяется по всему организму. Инкубационный период составляет от 3 до 32 дней.
Заболевание протекает в три фазы. I фаза - общетоксическая длится от 3 до 35 дней, проявляется лихорадкой, головными болями, миалгиями, полиартралгиями, тошнотой, симптомами фарингита, увеличением периферических лимфоузлов, печени, селезенки. В месте укуса клеща появляется папула, затем кольцевидная эритема, в последующем у 75% больных принимающая длительное, хроническое мигрирующее течение. II фаза - диссеминированная инфекция - развивается на 4-5 неделе и продолжается в течение 1-2 месяцев. В этой фазе наступает гематогенная диссеминация возбудителя. Наиболее существенными проявлениями болезни являются неврологические и кардиальные нарушения. Поражение нервной системы характеризуется симптомами серозного менингита, менингоэнцефалита, энцефаломиелита с пара- и тетрапарезами, парезами лицевого нерва, глазодвигательного нерва, часто развивается полирадикулоневрит.
Поражение сердца наблюдается у 8-10% больных. Характерно развитие атриовентрикулярной блокады различных степеней, при этом нередко возникает полная блокада с развитием синкопальных состояний. Возможна симптоматика типичного диффузного миокардита с кардиомегалией и сердечной недостаточностью, но все-таки это бывает редко. У некоторых больных развивается миоперикардит. Симптомы поражения сердца сохраняются около 6 недель, в дальнейшем у большинства больных наступает нормализация функций сердца.
У отдельных больных в биоптатах миокарда обнаруживаются боррелий, что является прямым диагностическим признаком заболевания и подтверждает точку зрения о том, что повреждение сердца обусловлено непосредственным внедрением возбудителя в миокард и воздействием его токсинов. Для диагностики повреждения миокарда при болезни Лайма применяют ЭКГ (выявляются нарушения атриовентрикулярной проводимости, неспецифические изменения зубца Т и интервала ST), радиоизотопное сканирование миокарда с радиоактивным галлием (накапливается в очагах поражения миокарда) или сканирование с применением антимиозиновых антител, меченных радиоактивным индием (антитела концентрируются в пораженных участках миокарда).
III фаза (артритическая) развивается через 6 и более недель от начала болезни (иногда через 2-3 месяца) и характеризуется поражением суставов в виде асимметричных артритов коленных и локтевых, межфаланговых, височно-челюстных суставов. Пораженные суставы болезненны, отечны, однако почти не гиперемированы. Возможны неоднократные рецидивы полиартрита, которые могут длиться несколько недель и даже месяцев. Однако развитие хронического артрита или полиартрита с развитием эрозий суставных поверхностей костей с разрушением хряща наблюдается лишь у отдельных больных. III фаза называется многими исследователями также хронической (Steere, 1998), потому что в этой стадии проявляется хроническое поражение нервной системы (энцефалопатия, полинейропатия, энцефаломиелит), кожи (хронический атрофический акродер-матит) и возможен рецидивирующий полиартрит.
Диагноз болезни Лайма ставится на основании следующих признаков: укусы клеща в анамнезе; появление мигрирующей кольцевидной эритемы с последующими признаками поражения нервной системы, сердца, суставов,обнаружение боррелий в спинномозговой жидкости, синовиальной жидкости, биоптатах кожи; определение наличия и концентрации специфических антителк боррелиям в организме больного такими методами, как им-мунофлюоресценция, реакция связывания комплемента, реакция непрямой гемагглютинации, иммуноферментный анализ ииммунный блоттинг.
Наиболее точными методами являютсяиммуноферментный анализ и иммуноблоттинг. Антитела к боррелиям обычно появляются у больных с болезнью Лайма на 3-6 неделе от начала заболевания, причем вначале образуются антитела класса Ig M, в более поздние сроки (через 1 месяц и позже) - антитела класса Ig G; определение ДНК боррелий методом полимеразной цепной реакции в биологическом материале: в кожном биоптате, крови, моче, суставной и цереброспинальной жидкости. Метод высокочувствителен и позволяет определить инфицированность пациента на 7 день от момента присасывания клеща, часто еще в инкубационном периоде.
Грибковые поражения миокарда
Грибковые поражения сердца являются довольно редкой патологией и наблюдаются лишь при тяжелом генерализованном течении грибковой инфекции. Обычно это бывает у больных, получавших массивную, длительную антибиотикотерапию, а также длительно и в больших дозах принимавших глюкокортикоидные препараты. Кроме того, генерализованная грибковая инфекция налюдается у больных СПИДом. Наиболее частыми видами грибковой инфекции, встречающимися в практике врача, являются актиномикоз, аспергиллез, кандидамикоз. При генерализованном течении чаще возникают перикардит и эндокардит. Миокард вовлекается в патологический процесс редко.
При генерализованном актиномикозе актиномицеты могут проникать в миокард, вызывать развитие некротизирующих абсцессов, окруженных грануляционной тканью. При этом отмечается тяжелая сердечная недостаточность. Поражение перикарда при актиномикозе характеризуется появлением выпота в полости перикарда, в последующем развитием констриктивного перикардита. Поражение миокарда при аспергиллезе наблюдается редко, но если оно возникает, то может привести к летальному исходу.
При патологоанатомическом исследовании больных, погибших от генерализованного аспергиллеза, в миокарде обнаруживаются грибковые мицеллы, абсцессы и некрозы миокарда. Кандидамикозное поражение миокарда обнаруживается также только при генерализованном течении кандидамикоза, в миокарде возможно развитие абсцессов, причем микроабсцессы локализуются чаще всего в области АВ-соединения и межжелудочковой перегородки, что приводит к развитию атриовентрикулярной блокады.
О грибковом поражении миокарда можно думать у больных с тяжелым, генерализованным системным микозом (обычно у лиц с выраженным иммунодефицитом, длительно лечившихся глюкокортикоидами, антибиотиками, цитостатиками) при наличии электрокардиографических изменений и клинических признаков дисфункции миокарда. У большинства больных при этом определяются симптомы поражения перикарда, а также почек, легких и других органов.
Миокардит при трипаносомозе
Трипаносомоз (болезнь Чагаса) - заболевание, вызываемое разновидностью простейших Tripanosoma cruzi (описана впервые Chagas в 1909 г.). Заболевание распространено преимущественно в Центральной и Южной Америке, Бразилии, Аргентине, Чили. В этих странах болезнь является ведущей причиной смерти в группе сердечно-сосудистых болезней. В настоящее время Tripanosoma cruzi инфицированы около 20 млн. человек. На других континентах, кроме Америки, заболевание не встречается.
Tripanosoma cruzi передается от млекопитающего к млекопитающему триатомовыми клопами, которые заражаются при заглатывании крови инфицированного животного или человека. В кишечнике клопа трипаносомы подвергаются ряду превращений, размножаются и выделяются с экскрементами клопа во время последующего кровососания Заражение человека происходит при попадании экскрементов клопа на участки поврежденной кожи и слизистые оболочки (например, конъюнктивы). Кроме того, возможно заражение от инфицированного человека при переливании его крови, при контакте с его кровью, а также трансплацентарным путем.
Первые симптомы болезни появляются приблизительно через 7-10 дней после заражения. Различают 3 фазы болезни: острую, латентную и хроническую. В острой фазе болезни в месте внедрения возбудителя появляется припухлость и покраснение кожи, увеличиваются регионарные лимфоузлы, при внедрении инфекции через конъюнктиву появляется отек век и периорбитальных тканей (симптом Романьи). Кроме местных проявлений наблюдаются общая слабость, лихорадка, отсутствие аппетита, отеки нижних конечностей, лица, увеличение печени, селезенки, периферических лимфоузлов. В острой фазе болезни Чагаса возможно развитие миокардита.
Трипаносомы проникают в миокард, вызывают развитие воспалительной клеточной инфильтрации, деструкцию кардиомиоцитов. В развитии миокардита при болезни Чагаса большое значение придается также развитию аутоиммунных процессов в миокарде и повреждающему влиянию цитотоксических Т-лимфоцитов. Миокардит в острой фазе заболевания имеет типичную клиническую картину и протекает обычно тяжело. В острой фазе возможно также развитие экссудативного перикардита, эндокардита, образование внутрисердечных тромбов. Однако постепенно все проявления острой фазы стихают, и больные вступают в латентную фазу заболевания. В этой фазе болезни нет отчетливой клинической симптоматики, однако в это время формируется кардиомиопатия, проявляющаяся неспецифическими изменениями электрокардиограммы. Хроническая фаза болезни Чагаса развивается спустя годы после заражения и наблюдается у 30% больных.
Важнейшей особенностью хронической фазы является поражение сердца в виде синдрома дилатационной кардиомиопатии и недостаточности кровообращения. Основными клиническими симптомами являются слабость, головокружения, одышка, отечность голеней и стоп, тахикардия, расширение границ сердца влево, глухость тонов сердца, часто протодиастоличес-кий ритм галопа, систолический шум в области верхушки сердца и мечевидного отростка, увеличенная болезненная печень. У многих больных отмечаются тахиаритмии, экстрасистолии, нарушение атриовентрикулярной проводимости.
У некоторых больных в дальнейшем развивается аневризма левого желудочка. Часто заболевание осложняется тромбоэмболией в сосуды малого и большого круга кровообращения. На рентгенограмме органов грудной клетки определяются кардиомегалия, застойные явления в легких. При электрокардиографическом исследовании выявляются изменения интервала ST, зубца Т, патологический зубец Q преимущественно в левых грудных отведениях, атриовентрикулярная блокада, нарушения внутрижелудочковой проводимости, различные нарушения сердечного ритма.
Характерными эхокардиографическими изменениями являются кардиомегалия, увеличение конечного диастолического и систолического объемов, снижение фракции выброса левого желудочка, нарушение диастолического наполнения желудочков, гипокинезия задней стенки левого желудочка, апикальная аневризма. Радионуклидная вентрикулография выявляет локальные нарушения подвижности стенок правого и левого желудочков, нарушение глобальной функции желудочков. Радиоизотопное сканирование миокарда с таллием-201 обнаруживает дефекты накопления изотопа в очагах фиброза и ишемии.
Диагностика болезни Чагаса в острой стадии осуществляется путем обнаружения трипаносом в свежей гепаринизированной крови больного или в лейкоконцентратах. Можно определить возбудителя в мазках крови и толстой капле, окрашенной по мет
Патогенез (что происходит?) во время Миокардит:
Повреждающее действие различных этиологических факторов, вызывающих развитие воспаления в миокарде, реализуется с помощью нескольких механизмов. Прямое цитолитическое действие этиологических факторов инфекционных агентов, внедряющихся в сердечную мышцу. Оно осуществляется с помощью миокардиальной инвазии (токсоплазмоз, бактерии) или так называемой репликации возбудителя, продолжающейся от нескольких дней до 2 недель от начала инфекции. Повреждение кардиомиоцитов и других клеток циркулирующими токсинами при системной инфекции (дифтерийный, скарлатинозный миокардиты). Неспецифическое повреждение клеток вследствие распространенных системных иммунопатологических реакций.
При системных заболеваниях соединительной ткани, лекарственной или сывороточной болезни сердце повреждается в результате реакции антиген-антитело, являясь как бы одним из органов-мишеней генерализованного аутоиммунного процесса. Специфическое повреждение кардиомиоцитов факторами клеточного (Т-лимфоциты) и гуморального (антитела) иммунитета, которые вырабатываются в ответ на относительно кратковременное внедрение возбудителя (вирусы Коксаки В, гриппа) или реактивированы первичной инфекцией, длительное время персистировавшей в различных органах (цитомегаловирус, вирусы гепатита).
Последний механизм является основным при развитии вирусных миокардитов. В этих случаях даже после “инактивации” вируса и невозможности его выделения из сердца, процесс иммунного повреждения клеток, “запущенный” вирусом, поддерживается благодаря вновь вырабатываемым антигенам кардиомиоцитов и антителам к ним. Этеровирус Коксаки В имеет большое сходство с клеточной мембраной кардиомиоцитов. Однажды запущенный процесс выработки антител к вирусу продолжается и после его “инактивации” и стимулируется антигенной структурой самого кардиомиоцита. В результате происходит постоянное иммунное повреждение кардиомиоцитов.
Воздействие любого этиологического фактора и сопровождающего его иммунопатологического процесса на миокард приводит к глубоким нарушениям структуры кардиомиоцитов, интерстициальной ткани, микроциркуляторного сосудистого русла и к развитию в сердечной мышце воспалительного инфильтрата, состоящего из лимфоцитов, нейтрофилов, эозинофилов, макрофагов и других клеток. Наблюдается полнокровие сосудов микроциркуляторного русла, спазм артериол, парез капилляров и вен, эритроцитарные стазы и фибриновые микротромбы. Нарушается сосудистая проницаемость и развивается отек стромы. Характерно повреждение и некроз кардиомиоцитов, замещение их фиброзной тканью.
Электронно-микроскопическое, гистохимическое исследования выявляют нарушения ультраструктуры миокарда, важнейшим из которых является повреждение митохондрий. Уменьшается количество гранул гликогена в мышечных клетках, нарушается процесс утилизации глюкозы и β-окисление жирных кислот, снижается энергетический метаболизм кардиoмиоцитов. Возникают изменения миокарда, определяющие клинику и прогноз болезни: воспалительный клеточный инфильтрат, отек стромы, некрозы, дистрофии, развитие фиброзной ткани; снижение сократимости миокарда, систолической функции ЛЖ, нередко с развитием значительной дилатации камер сердца; диастолическая дисфункция ЛЖ, возникающая в результате повышенной ригидности сердечной мышцы и угнетения процесса активного расслабления; застой в венах малого или (реже) большого круга кровообращения; формирование электрической негомогенности и нестабильности миокарда желудочков, существенно повышающих риск возникновения желудочковых аритмий; очаговое повреждение проводящей системы сердца с развитием внутрижелудочковых и атриовентрикулярных блокад.
В ответ на внедрение возбудителя в кардиомиоциты, в ткани миокарда развиваются специфические и неспецифические изменения. Специфические изменения - это клеточная инфильтрация, которая может состоять из лимфоцитов, нейтрофилов, эозинофилов и гистиоцитов. При острых миокардитах воспалительная инфильтрация в миокарде сохраняется достаточно непродолжительное время (2-3 недели), уступая место фибробластам с формированием кардиосклероза. При миокардитах затяжного и хронического течения лимфоклеточная инфильтрация сохраняется в миокарде достаточно длительное время (в течение нескольких месяцев), при этом параллельно с воспалением формируется миокардитический кардиосклероз.
Миокардитический кардиосклероз появляется после 14 дня заболевания, сначала в виде отдельных волокон коллагена, а затем - в виде локальных очагов и полей фиброза. По площади фиброз может быть диффузным и очаговым, а по структуре заместительным, интерстициальным и периваскулярным Миокардитический кардиосклероз является своеобразным маркером предшествующего воспаления, поэтому при наличии в миокарде и воспалительной инфильтрации и кардиосклероза, следует думать о рецидиве миокардита.
Помимо клеточной инфильтрации в миокарде выявляются неспецифические признаки, отек межклеточного пространства, полнокровие сосудов микроциркуляторного русла и дистрофические изменения кардиомиоцитов. Дистрофия кардиомиоцитов проявляется тем, что в цитоплазме клеток увеличивается содержание жировых включений и гликогена (жировая дистрофия), а в ядрах появляется краевая узурация и снижение хроматина. При электронной микроскопии в кардиомиоцитах отмечается «запустевание» клетки, т.е. уменьшение количества органелл (митохондрий, миофибрилл) с появлением центральной вакуоли.
При миокардитах хронического течения, воспалительная инфильтрация, кардиосклероз и дистрофия кардиомиоцитов выявляются одновременно. От выраженности и соотношения этих морфологических изменений зависят клинические проявления заболевания, изменения лабораторных и инструментальных показателей.
Симптомы Миокардит:
КЛАССИФИКАЦИЯ
Международная статистическая классификация болезней (МКБ-10), переход на которую в России осуществлен с 1.01.1999 г. в соответствии с Приказом Минздрава России № 3 от 12 января 1998 г., выделяет миокардиты и кардиомиопатии, которые отнесены кIиIXклассам (таблица 27).
Таблица 27. Классификация МКБ-10
| Наименование | Код |
| Острый ревматический миокардит | I01.2 |
| Ревматический миокардит | I09.0 |
| Острый миокардит | I40 |
| Инфекционный миокардит | I40.0 |
| Другие виды острого миокардита | I40.8 |
| Острый миокардит неуточненный | I40.9 |
| Миокардит при болезнях, классифицированных в других рубриках | I41 |
| Миокардит при бактериальных болезнях, классифицированных в других рубриках | I41.0 |
| Миокардит при вирусных болезнях, классифицированных в других рубриках | I41.1 |
| Миокардит при инфекционных и паразитарных болезнях, классифицированных в других рубриках | 141.2 |
| Миокардит при других болезнях, классифицированных в других рубриках | 141.8 |
| Миокардит неуточненный | I51 4 |
| Кардиомиопатия при инфекционных и паразитарных болезнях, классифицированных в других рубриках | I43.0 |
| Поражение сердечно-сосудистой системы при других инфекционных и паразитарных болезнях, классифицированных в других рубриках | I98.1 |
| Другие поражения сердца при бактериальных болезнях, классифицированных в других рубриках | I52.0 |
| Другие поражения сердца при других инфекционных и паразитарных болезнях, классифицированных в других рубриках | I52.1 |
| Другие поражения сердца при других болезнях, классифицированных в других рубриках | I52.8 |
Все острые воспалительные процессы в миокарде в Международной классификации указаны как миокардиты. По виду этнологического агента они разделены па миокардит при бактериальных болезнях, миокардит при вирусных болезнях, миокардит при других инфекционных и паразитарных болезнях, миокардит при болезнях, классифицированных в других рубриках и миокардит пеуточнениый. Все хронические процессы в мышце сердца, воспалительного и невоспалителыюго гепеза в МКБ-10 называются кардиомиопатиями.
Классификация выделяет специфические кардиомиопатни: дилатациоппую, ишемическую, гипертрофическую, рестриктивпую и эндокардиальный фибробластоз. К неспецифическим кардиомиопатиям относятся: алкогольная, обусловленная воздействием лекарственных средств, внешних факторов, кардиомиопатия при инфекционных и паразитарных болезнях, при метаболических нарушениях, при расстройствах питания. МКБ-10 является статистическим перечнем болезней, она не в полной мере удовлетворяет потребности практикующих врачей, поэтому для определения патогенетического варианта заболевания, его клинической характеристики и течения необходимо пользоваться клинической классификацией.
В настоящее время единой клинической классификации миокардитов не существует. Перспективно разделение миокардитов по этиологическому принципу, применение которого возможно только при использовании всего арсенала современных лабораторно-инструментальных методов исследования, включая эндомиокардиальную биопсию, развернутое иммунологическое исследование, выявление инфекционного возбудителя миокардитов с помощью реакции PCR.
Такое обследование больных с подозрением на наличие миокардита, преимущественно инфекционного, доступно крупным кардиологическим центрам. В ряде случаев клиническая картина заболеваний, осложненных развитием миокардита, столь очевидна, что этиология воспалительного поражения сердечной мышцы не вызывает сомнений (лекарственные миокардиты, сывороточные миокардиты, миокардиты при СКВ, ожогах). Сложнее обстоит дело с выделением инфекционных, вирусных миокардитов.
Миокардиты классифицируют по патогенетическим вариантам: инфекционные и инфекционно-токсические; аллергические (иммунологические), в том числе инфекционно-аллергические; токсико-аллергические. По распространенности воспалительного процесса принято делить все миокардиты на: очаговые; диффузные. По течению миокардиты могут быть острыми; подострыми; рецидивирующими; латентными; хроническими.
По характеру воспалительного процесса различают: альтернативный миокардит (дистрофически-некробиотический); экссудативнопролиферативный (дистрофический, воспалительноинфильтративный, смешанный, васкулярный). Выделяют также патогенетические фазы инфекционных миокардитов: инфекционно-токсическая; иммунологическая; дистрофическая; миокардиосклеротическая (таблица 28).
Таблица 28. Клиническая классификация миокардитов (Палеев Н.Р., Палеев Ф.Р., Гуревич М.А., 2007)
| I. Этиологическая характеристика и патогенетические варианты: 1.Инфекционно-аллергические и инфекционные: Вирусные (грипп, вирусы Коксаки, ECHO, СПИД, полиомиелит) Инфекционные (дифтерия, скарлатина, туберкулез, брюшной тиф) При инфекционном эндокардите Спирохетозные (сифилис, возвратный тиф, лептоспироз) Риккетсиозные (сыпной тиф, лихорадка Ку) Паразитарные (токсоплазмоз, болезнь Чагаса, трихинеллез) Грибковые (актиномикоз, кандидоз, кокцидиомикоз, аспергиллез и др.) 2. Аллергические (иммунологические): Лекарственные, Сывороточные, Нутритивные, При системных заболеваниях соединительной ткани, При бронхиальной астме, При синдроме Лайелла, При синдроме Гудпасчера, Ожоговые, Трансплантационные 3. Токсико-аллергические: Тиреотоксические, Уремические, Алкогольные II. Патогенетическая фаза:Инфекционно-токсическая, Иммуноаллергическая, Дистрофическая, Миокардиосклеротическая | III. Морфологическая характеристика: Альтеративный (дистрофическинекробиотический): Экссудативно-пролиферативный (интерстициальный): а) дистрофический б) воспалительно-инфильтративный в) васкулярный г) смешанный IV. Распространенность: Очаговые Диффузные V. Клинические варианты: Псевдокоронарный, Декомпенсационный, Псевдоклапанный, Аритмический, Тромбоэмболический, Смешанный, Малосимптомный VI. Варианты течения:Миокардит доброкачественного течения (обычно очаговая форма), Острый миокардит тяжелого течения, Миокардит рецидивирующего течения с повторяющимися обострениями, Миокардит с нарастающей дилатацией полостей сердца и в меньшей степени гипертрофией миокарда (обычно диффузная форма), Хронический миокардит |
Важно выделение нескольких клинических вариантов болезни зависимости от преобладающих клинических проявлений миокардитов: малосимптомного; псевдокоронарного; декомпенсационного; аритмического; псевдоклапанного; тромбоэмболического; смешанного. В клинической практике точная диагностика каждой из приведенных характеристик миокардитов часто вызывает большие затруднения.
При обозначении острого воспалительного процесса в миокарде в истории болезни необходимо придерживаться рекомендаций МКБ-10 и указывать заболевание, как «острый миокардит», по возможности называя этиологический фактор. Правомочны термины «инфекционный миокардит», «бактериальный миокардит», «вирусный миокардит» или «дифтерийный миокардит» и прочие с обязательным микробиологическим подтверждением диагноза. При затяжном или хроническом течении миокардита необходимо пользоваться клинической классификацией и использовать термин «хронический миокардит». Этот термин разрешен к использованию комитетом экспертов ВОЗ в 1997 г.
Термины «инфекционно-аллергический миокардит» и «неревматический миокардит», которые использовались достаточно широко, следует заменить на «хронический миокардит». При хроническом течении миокардита, ассоциированным с хроническим инфекционным заболеванием, и сопровождающимся дилатацией камер сердца, правомочными считаются термины «кардиомиопатия при инфекционных и паразитарных болезнях» и «воспалительная кардиомиопатия».
Клиническая картина определяется этиологией, патогенетическим вариантом, распространенностью, преимущественной локализацией и характером воспалительного процесса, а также степенью нарушения сократимости ЛЖ. Признаки сердечной недостаточности развиваются при диффузном поражении сердечной мышцы, хотя даже ограниченный воспалительный процесс, локализованный в области проводящей системы сердца, может привести к тяжелым последствиям (АВ-блокады, желудочковые аритмии высоких градаций). В некоторых случаях наблюдается бессимптомное или малосимптомное течение миокардита.
Вследствие воспалительной инфильтрации, дистрофических изменений кардиомиоцитов и миокардитического кардиосклероза развивается систолическая и диастолическая дисфункции, возникают различные нарушения ритма и проводимости, и происходит постепенная дилатация камер сердца. Увеличение камер сердца может сопровождаться компенсаторной гипертрофией миокарда с увеличением индекса массы миокарда левого желудочка. В редких случаях воспаление может приводить к крупноочаговому некрозу миокарда с развитием аневризмы левого желудочка. Миокардит может сопровождаться сопутствующим перикардитом с накоплением жидкости в полости перикарда.
Клиническим эквивалентом систолической дисфункции левого желудочка являются признаки сердечной недостаточности. Возникновение и прогрессирование СН связано со снижением сердечного выброса (с систолической дисфункцией) и с застоем крови в легочных и системных венах выше ослабленного отдела сердца. Компенсаторные механизмы коррекции ХСН включают: тахикардию, более активное участие предсердий в центральной гемодинамике, увеличение объема и массы ЛЖ; увеличение общего периферического сопротивления сосудов вследствие повышения тонуса симпатической нервной системы, повышение концентрации катехоламинов в крови, активацию ренин-ангиотензиновой системы и вазопрессина. Компенсация может продолжаться достаточно длительное время и только при истощении компенсаторных механизмов появляются характерные жалобы и изменения лабораторных и инструментальных показателей.
Жалобы на слабость, повышенную утомляемость, сердцебиения, небольшую лихорадку, появляющиеся на фоне реконвалесценции после перенесенной вирусной или бактериальной инфекции, нередко связывают с основным заболеванием, осложненным интоксикацией, а специального целенаправленного исследования сердечно-сосудистой системы не проводят. Через некоторое время эти клинические проявления миокардита проходят самостоятельно, и факт воспалительного поражения сердца часто остается незамеченным. В других случаях клиническая картина заболевания более определенно указывает на возможное поражение сердца (аритмии, боли в области сердца, одышка, изменения ЭКГ), что заставляет врача более внимательно отнестись к поиску объективных подтверждений миокардита.
При инфекционных, инфекционно-токсических, инфекционно-аллергических миокардитах в большинстве случаев обнаруживается отчетливая связь этих и других имптомов миокардита с инфекцией. Инфекционные и инфекционно-токсические миокардиты развиваются в первые дни инфекционного заболевания, а инфекционно-аллергические - спустя 2-3 недели после него. Этого времени бывает достаточно для формирования иммунопатологических реакций на инфекционный процесс. При лекарственных миокардитах прослеживается связь с приемом тех или иных лекарственных препаратов и генерализованной аллергической реакции на них.
Жалобы
У больных с вирусной инфекцией сохраняются неспецифические жалобы, связанные с поражением многих органов и систем: ЦНС и вегетативной нервной системы (слабость, головная боль, повышенная утомляемость, выраженная потливость); органов дыхания (насморк, кашель, слезотечение, осиплость голоса, боли в горле при глотании); мышц и суставов (артралгии, миалгии); желудочно-кишечного тракта (анорексия, диарея, тошнота, боли в животе). К числу первых кардиальных жалоб относятся боли в области сердца, одышка, прогрессирующая мышечная слабость, утомляемость, снижение работоспособности. Боли в области сердца - одна из наиболее частых кардиальных жалоб больных миокардитом. Боли локализуются в области верхушки сердца и слева от грудины, носят давящий, ноющий, колющий характер. В отличие от стенокардии при ИБС, боли при миокардите продолжительные, почти постоянные, не связаны с физической нагрузкой и не купируются нитроглицерином.
Одышка при физической нагрузке и в покое является первым субъективным признаком развивающейся левожелудочковой недостаточности. Одышка может усиливаться в горизонтальном положении больного (ортопноэ) за счет увеличения венозного притока крови к правым отделам сердца. Приступы удушья возникают сравнительно редко, лишь при значительном застое крови в легких и тяжелом течении миокардита (в случаях гигантоклеточного миокардита).
При внезапном возникновении удушья, сопровождающегося болями в грудной клетке, диагноз следует дифференцировать с тромбоэмболией легочной артерии (ТЭЛА). Сердцебиения (тахикардия) весьма характерны для миокардита и связаны с активацией САС, развивающейся на фоне уменьшения ударного выброса. Перебои в работе сердца обусловлены разнообразными нарушениями ритма (наджелудочковая и желудочковая экстрасистолия, пароксизмы фибрилляции предсердий, наджелудочковой и желудочковой тахикардии, АВ-блокады II степени).
Перебои могут появляться в покое и усиливаться при физической нагрузке. Отеки на ногах, боли в правом подреберье и другие проявления правожелудочковой недостаточности сравнительно редко выявляются у больных острым миокардитом. Они больше характерны для рецидивирующего или хронического течения заболевания, когда признаки застоя крови в венах большого круга кровообращения возникают после относительно длительного периода прогрессирующей легочной гипертензии и сопровождаются дилатацией ПЖ.
Лихорадка - частый, но не обязательный признак миокардита. В острых случаях она может быть обусловлена как инфекционным заболеванием, так и иммунным воспалением, локализованным в сердечной мышце. При хроническом или затяжном течении миокардита, когда признаки вызвавшего его инфекционного заболевания уже отсутствуют, повышение температуры тела (обычно до субфебрильных цифр) указывает на активный процесс иммунного воспаления в сердце, особенно, если лихорадка сочетается с усугублением кардиальной симптоматики и отрицательной динамикой ЭКГ. Следует все же помнить, что повышение температуры тела у больного с хроническим миокардитом имеет относительное диагностическое значение, поскольку отсутствие лихорадки еще не исключает активного воспалительного процесса в сердечной мышце.
Физикальное исследование
Общий осмотр и исследование органов дыхания, пищеварения и почек. При общем осмотре и исследовании органов дыхания, пищеварения, почек каких-либо специфических признаков, характерных для миокардитов, выявить не удается, за исключением внешних проявлений левожелудочковой и (реже) правожелудочковой недостаточности, которые можно обнаружить при сравнительно тяжелом течении заболевания: положение ортопноэ, тахипноэ, акроцианоз, застойные влажные хрипы в легких, небольшие отеки ног.
Более выраженные проявления правожелудочковой или бивентрикулярной недостаточности в виде значительной гепатомегалии, асцита, анасарки для больных острым миокардитом не характерны. Они могут указывать на наличие сопутствующего выпотного или констриктивного перикардита или других заболеваний, сопровождающихся застоем крови в венах большого круга кровообращения.
Появление внешних признаков бивентрикулярной сердечной недостаточности у больных с длительным течением миокардита в ряде случаев может указывать на трансформацию миокардита в ДКМП. Следует помнить также, что детальное физикальное исследование больного позволяет обнаружить признаки основного заболевания, явившегося причиной развития миокардита (, системных заболеваний соединительной ткани, лекарственной болезни, вирусной или бактериальной инфекции, тиреотоксикоза, уремии).
Пальпация, перкуссия сердца
При малосимптомных миокардитах каких-либо существенных изменений границ сердца выявить не удается. У больных с умеренной степенью тяжести и тяжелым миокардитом выявляется смещение верхушечного толчка и левой границы относительной тупости сердца влево. Верхушечный толчок иногда ослаблен. Еще реже можно наблюдать смещение верхней границы сердца и исчезновение “талии” сердца, что указывает на дилатацию ЛП. Вправо границы сердца смещаются при тяжелой бивентрикулярной недостаточности.
Аускультация сердца
В легких случаях заболевания обычно определяется незначительное ослабление I и II тонов сердца. В тяжелых случаях миокардита отмечается выраженная глухость тонов. Иногда тоны вовсе не выслушиваются. Нередко обнаруживают также расщепление I тона, степень которого часто коррелирует с выраженностью патологического процесса в сердечной мышце. Протодиастолический ритм галопа является нередкой находкой в тяжелых случаях заболевания, свидетельствуя о снижении сократительной способности миокарда ЛЖ и выраженной систолической дисфункции миокарда, вызванной воспалительным отеком сердечной мышцы. Нарушения ритма сердца при миокардитах встречаются довольно часто. Чаще всего речь идет о синусовой аритмии, суправентрикулярной и желудочковой экстрасистолии, тахикардии, брадикардии и других нарушениях ритма.
Систолический шум при миокардитах чаще обусловлен поражением папиллярных мышц или значительным расширением фиброзного кольца митрального клапана с развитием относительной митральной недостаточности. Значительная дилатация ПЖ при его перегрузке способствует возникновению относительного стеноза ЛА с появлением систолического шума во ІІ-ІІІ межреберье слева от грудины. Диастолический шум иногда также может выслушиваться у больных миокардитом при выраженной дилатации ЛЖ, способствующей формированию относительного стеноза левого атриовентрикулярного отверстия (шум Кумбса). Сочетание протодиастолического ритма галопа с коротким мезодиастолическим шумом меняющейся интенсивности свидетельствует о наличии миокардита.
Артериальный пульс, АД
В легких случаях миокардита при исследовании пульса изменений не обнаруживают, за исключением синусовой тахикардии, не соответствующей тяжести лихорадки. При уменьшении сократимости ЛЖ и развитии сердечной недостаточности выявляется тахикардия, реже брадикардия, различные нарушения ритма. Иногда можно обнаружить альтернирующий пульс. Систолическое и пульсовое давления уменьшаются при снижении сердечного выброса.
Осложнения
К числу наиболее серьезных осложнений миокардита относятся: нарушения сердечного ритма (экстрасистолия, пароксизмальные тахикардии, в том числе желудочковая тахикардия, фибрилляция предсердий; нарушения внутрижелудочковой и атриовентрикулярной проводимости; внутрижелудочковые тромбозы и тромбоэмболические осложнения; внезапная сердечная смерть.
ТЕЧЕНИЕ И ПРОГНОЗ
Латентное течение миокардита характеризуется отсутствием клинической симптоматики, и выявить его можно только с помощью инструментальных и лабораторных методов исследования. Прогноз при миокардите зависит от распространенности воспалительного процесса в миокарде (очаговый, диффузный миокардит), степени тяжести миокардита, наличия сопутствующих заболеваний Легкие (часто очаговые) миокардиты заканчиваются полным выздоровлением При миокардите средней степени тяжести у большинства больных наступает выздоровление, однако процесс выздоровления может затягиваться до 3-6 месяцев, при этом у 10-15% больных могут в последующем определяться явления постмиокардитического кардиосклероза (в зарубежной литературе этот термин не используется) в виде экстрасистолической аритмии, нарушений внутрижелудочковой или атриовентрикулярной проводимости, но симптоматики сердечной недостаточности нет.
При тяжелой форме миокардита прогноз может быть неблагоприятным, летальные исходы могут быть у 8-15% больных Смерть может наступить от сердечной недостаточности, тромбоэмболических осложнений, фибрилляции желудочков. Прогноз в определенной мере зависит также от этиологической формы и варианта течения миокардита. Острые вирусные миокардиты имеют более благоприятный прогноз, чем подострые и хронические. Крайне редко встречающийся гигантоклеточный миокардит имеет очень плохой, практически безнадежный прогноз. Неблагоприятен прогноз при миокардите у больных ВИЧ-инфекцией и системными заболеваниями соединительной ткани. В ряде случаев у больных, перенесших острый миокардит, развивается хронический миокардит.
В настоящее время имеются клинические наблюдения за течением вирусного миокардита с использованием эндомиокардиальной биопсии (Quigley и соавт., 1987; O'Connel и соавт., 1989), согласно которым одним из возможных исходов вирусного миокардита, преимущественно тяжелого течения, является развитие дилатационной кардиомиопатии. Гистологическая картина биоптатов миокарда у этих больных была идентична гистологической картине биоптатов миокарда пациентов с идиопатической дилатационной кардиомиопатией без предшествующего инфекционного миокардита.
Дилатационную кардиомиопатию как исход миокардита многие называют постмиокардитической дилатационной кардиомиопатией.
Воспалительные заболевания миокарда могут протекать в острой, подострой и хронической формах с постепенным исходом в ХСН. Клиническое течение миокардитов бывает разнообразным: с выздоровлением при адекватном лечении, или быстро наступающей смертью; с медленно прогрессирующей дилатацией и гипертрофией сердца; с повторными обострениями и нарастанием СН.
У большинства пациентов (60-70%) отмечается улучшение состояния па фоне лечения п обратная динамика лабораторных и инструментальных показателей. Но о выздоровлении можно говорить не ранее, чем через 6-12 месяцев после лечения, потому что течение миокардита может иметь волнообразное течение с периодами обострений и ремиссий. У 15-20% больных заболевание имеет рецидивирующее течение с исходом каждого эпизода воспаления в кардиосклероз и с неуклонным прогрессировапием застойной сердечной недостаточности. В 5-10% случаев миокардит имеет непрерывно-прогрессирующее течение. Летальные исходы заболевания, несмотря на лечение, отмечаются в 1-5% случаев.
К неблагоприятным факторам, влияющим па течение и исход миокардитов, относят: снижение фракции выброса менее 35%; увеличение диастолических размеров левого желудочка более 65 мм; уменьшение индекса сферичности ЛЖ менее 1,4; хроническую сердечную недостаточность III-IV ф.к.; признаки крупноочагового миокардитического кардиосклероза (зубец QS на ЭКГ, аневризма ЛЖ на ЭхоКГ); повышение центрального венозного давления выше 25 мм водного столба.
Все летальные исходы при миокардитах связаны с хронической СН, аритимиями (фибрилляция желудочков, остро возникшая AV блокада 2-3 степени, тахисистолическая форма мерцательной аритмии), тромбоэмболиями. Прогноз заболевания зависит от частоты и продолжительности рецидивов заболевания, от состояния гуморального иммунитета, особенно от концентрации ФНО-а и антител к миокарду. Критерии стойкой клинико-лабораторной ремиссии миокардита - это отсутствие прогрессирующей дилатации камер сердца; увеличение фракции выброса; стабилизация признаков хронической сердечной недостаточности; стабилизация нарушений ритма и проводимости; отсутствие в крови кардиальных антигенов и адгезионных молекул; снижение концентрации антител к миокарду, интерлейкинов 1, 6, 8 и фактора некроза опухоли; отсутствие лейкоцитарной инфильтрации в миокарде.
Диагностика Миокардит:
ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Лабораторные исследования
Наиболее важной является лабораторная диагностика воспалительного синдрома, а также выявление маркеров повреждения и некроза кардиомиоцитов. Повышение активности кардиоспецифических ферментов в крови, которое обнаруживается у части больных миокардитом, отражает повреждение и некроз кардиомиоцитов: увеличение ЛДГ и ее фракций (ЛДГ1и ЛДГ2), причем ЛДГ1> ЛДГ2; КФК и МВ-фракции КФК; аспарагиновой аминотрансферазы (АсАТ); увеличение уровня сердечного тропонина.
Увеличение активности указанных ферментов (КФК, ЛДГ, АсАТ) является неспецифическим и может быть обусловлено инфекционным заболеванием, интоксикацией, разнообразными повреждениями скелетных мышц, острым ИМ, болезнями печени. По сравнению с аналогичным повышением ЛДГ, КФК и их фракций у больных острым ИМ, гиперферментемия при миокардитах выражена в меньшей степени, но сохраняется более длительное время - в течение всего периода активного воспалительного и некробиотического процесса в сердечной мышце.
Неспецифическими маркерами воспаления являются: увеличение СОЭ; повышение содержания С-реактивного протеина; лейкоцитоз; сдвиг лейкоцитарной формулы крови влево; возросший уровень фибриногена, серомукоида “Воспалительные” изменения в анализах крови, наряду с субфебрилитетом, закономерно выявляют у больных острым миокардитом. При хронических и подострых формах миокардита эти изменения отсутствуют, несмотря на наличие активного воспалительного процесса в сердечной мышце. Иммунологические исследования позволяют выявить неспецифические изменения клеточного и гуморального иммунитета, а также четырехкратное повышение титра вируснейтрализующих и противокардиальных антител, а также повышение уровня Ig G, Ig М, Ig А.
Этиологическая диагностика
При обследовании больных миокардитом определенное внимание следует уделить выявлению этнологических причин миокардита. Воспаление в сердечной мышце может быть осложнением любого острого инфекционного заболевания, поэтому при сборе анамнеза заболевания необходимо уточнить перепесенные заболевания. Окончательное решение об объеме микробиологического обследования и методах диагностики принимает лечащий врач. Диагностический поиск необходимо проводить по следующим направлениям: 1) обследование крови на наличие антигенов и специфических антител как острых, так и хронических инфекционных патогенов; 2) целенаправленное выявление очагов хронической инфекции.
В случаях манифестации миокардита через 2-3 недели после перенесенного острого респираторного заболевания следует провести обследование крови па наличие антигенов и антител к вирусам гриппа А, Коксаки А и эптеровирусам, потому что они обладают наибольшей кардиот-ропностыо. Если признаки миокардита появились после перенесенной ангины, необходимо изучать посевы слизи из зева и носоглотки на наличие патогенных стрептококков, стафилококков и возбудителей дифтерии, параллельно с этим целесообразно определить антитела к этим возбудителям.
В случаях появления признаков сердечного заболевания после острых кишечных инфекций, следует проводить посевы кала па дизентерийную группу, сальмонеллез, брюшной тиф и паратифы с обязательным исследованием крови па специфические антитела к этим возбудителям. Если больной параллельно с жалобами кардиологической направленности отмечает упорные артралгии, необходимо дополнительное обследование для исключения ревматизма, ревматоидного артрита и других заболеваний соединительной ткани, а также проводить микробиологическое обследование на наличие хламидийной инфекции и клещевого Лайм-боррелиоза.
Однако не всегда, даже при острых миокардитах, удается верифицировать возбудителя острой инфекции. Достаточно часто воспалительное заболевание миокарда вызывают возбудители хронических инфекций -вирусы простого герпеса, вирусы Эпштейпа-Барра, боррелпи, токсоплаз-мы, хламидии, цнтомегаловирусы, вирусы гепатита В и С. Эти внутриклеточные инфекционные агенты способны к длительной персистеиции в организме, негативно влияя па состояние клеточного и гуморального иммунитета, и создавая благоприятные условия для патологического влияния факторов, в обычных условиях не имеющих самостоятельного значения (переутомление, стресс, переохлаждение).
В настоящее время в лабораторной диагностике инфекций приоритетными считаются следующие методики: выделения возбудителя из биологических сред и накопление его in vitro , что позволяет установить серотип микроорганизма н определить чувствительность его к антибактериальным препаратам; - выявление внутриклеточных патогенов в биоптатах миокарда ( in situ ) с помощью иммупофлюоресцептпой микроскопии с использованием индикаторных антител с флюоресцирующими веществами; поиск инфекционных антигенов (ДНК любого возбудителя) в крови больного посредством полимеразной цепной реакции; определение в крови специфических антител к инфекционным патогенам посредством иммупофермептпого анализа или непрямым методом флюоресцирующих антител.
Остальные серологические методики обнаружения микробных и вирусных антигенов и антител проигрывают вышеперечисленным методам по чувствительности, специфичности и диагностической точности. Помимо микробиологического обследования необходимо проводить у больных целенаправленное выявление очагов хронической инфекции (тонзиллит, гайморит, кариес, периодонтит, адпексит, простатит). Необходимо привлекать к осмотрам соответствующих специалистов - стоматологов, оториноларингологов, урологов, гинекологов.
Электрокардиография
Патологические электрокардиографические изменения при миокардитах наблюдаются у 50-90% больных, они неспецифичны и связаны с воспалительной инфильтрацией, с дистрофией кардиомиоцитов и с миокарди-тическим кардиосклерозом. В зависимости от локализации воспалительного процесса отмечается значительная вариабельность изменений па ЭКГ. Воспалительная инфильтрация в области правого предсердия может сопровождаться синусовой тахикардией, суправентрикулярной экстрасистолией и мерцательной аритмией. Вовлечение в патологический процесс межжелудочковой перегородки вызывает нарушение предсердно-желудочковой проводимости и блокады ножек пучка Гиса. Реполяризационные изменения конечной части желудочкового комплекса отмечаются при появлении жидкости в полости перикарда, при дистрофии кардиомиоцитов и при миокардитическом кардиосклерозе.
К наиболее частым ЭКГ-синдромам миокардитов по коду Миннесота относят изменение зубца Т (уплощение, инверсия), которое встречается у 50-70% больных. Вторым по частоте проявлением на ЭКГ является изменение сегмента ST (30-50%). Сегмент ST - T может смещаться вниз или вверх от изоэлектрической линии в зависимости от поражения субэндо - или субэпикардиальных слоев миокарда и сопутствующего перикардита. Третьим ЭКГ-синдромом является наджелудочковая и желудочковая экстрасистолия (25-45%).
Экстрасистолы могут быть единичными и множественными, может регистрироваться пароксизмальная мерцательная аритмия и желудочковая тахикардия. Нарушения проводимости (синоатриальные и атриовентрикулярные блокады) наблюдаются достаточно редко - только в 5-15% случаев, значительно чаще (до 30%) отмечаются блокады ножек пучка Гиса. Внедрение в широкую клиническую практику суточного мониторирования ЭКГ у больных миокардитом позволяет регистрировать преходящие нарушения ритма и проводимости.
Стойкие (на протяжении нескольких месяцев и лет) нарушения ритма и проводимости, и реполяризационные изменения являются характерными признаками миокардитического кардиосклероза. В редких случаях (у 0,5-3% больных) миокардит может стать причиной развития крупных очагов некроза. В подобных случаях на электрокардиограмме отмечаются изменения, характерные для острого инфаркта миокарда (формируется патологический зубец QS ) в соответствующих отведениях.
К частым электрокардиографическим находкам относятся нарушения проводимости: внутрижелудочковые и атриовентрикулярные блокады. Существует корреляция между тяжестью миокардита и выраженностью нарушений проводимости. В легких случаях нарушения проводимости обычно отсутствуют или проявляются АВ-блокадой I степени. АВ-блокады II-III степени, блокады левой или (реже) правой ножки пучка Гиса свидетельствуют о наличии тяжелого диффузного миокардита, отличающегося весьма неблагоприятным прогнозом.
Нередко фиксируются различные нарушения сердечного ритма: синусовая тахикардия или (редко) брадикардия, экстрасистолия, фибрилляция или трепетание предсердий, пароксизмальная желудочковая и суправентрикулярная тахикардия. В тяжелых случаях, заканчивающихся внезапной смертью, при мониторном ЭКГ-наблюдении можно зарегистрировать фибрилляцию желудочков. Нарушения ритма и проводимости при малосимптомных миокардитах являются единственными маркерами патологического процесса в сердечной мышце.
Весьма важны в диагностике заболевания изменения желудочкового комплекса QRS. Диффузный распространенный миокардит часто сопровождается низким вольтажем зубцов R. В более редких случаях на ЭКГ выявляются инфарктоподобные изменения - патологический зубец Q, возникающий в результате неравномерного поражения сердечной мышцы, повреждения кардиомиоцитов и резкого снижения их электрической активности.
Эхокардиография
Поскольку специфические эхокардиографические признаки миокардита отсутствуют, ультразвуковое исследование сердца проводят с целью определения размеров ЛЖ и ЛП, для динамической оценки систолической и диастолической функций сердца. При бессимптомном и малосимптомном миокардитах данные ЭхоКГ могут быть нормальными или указывать лишь на небольшое увеличение КДО и КСО ЛЖ. В более тяжелых случаях, сопровождающихся снижением сократимости миокарда, выявляют уменьшение ФВ (меньше 50%), СИ и более значительное увеличение КДО, КСО и размеров ЛП. Снижение ФВ ниже 30% считают очень плохим прогностическим признаком.
Помимо снижения глобальной систолической функции ЛЖ, примерно у половины больных с тяжелым течением воспалительного процесса в сердечной мышце определяют локальные нарушения сократимости ЛЖ в виде гипокинезии и акинезии отдельных его сегментов. Эти данные требуют проведения дифференциальной диагностики с аналогичными изменениями у больных ИБС. При значительной дилатации ЛЖ и возникновении дисфункции клапанного аппарата (папиллярные мышцы, клапанные кольца) можно обнаружить признаки относительной недостаточности митрального клапана, митральной регургитации и заметное увеличение размеров ЛП.
В некоторых случаях в острой стадии заболевания можно выявить значительное диффузное утолщение стенки ЛЖ, обусловленное резко выраженным интерстициальным отеком. Эти изменения обратимы и на фоне адекватной противовоспалительной терапии толщина стенки ЛЖ сравнительно быстро нормализуется. Обычно в этих случаях определяются признаки выраженной диастолической дисфункции ЛЖ, обусловленной возросшей ригидностью отечной стенки. У 15% больных с тяжелым течением заболевания при ЭхоКГ-исследовании обнаруживают внутрисердечные тромбы, являющиеся источником тромбоэмболий. Дисфункция ПЖ и его умеренная дилатация выявляются у 15-20% больных.
Важным показателем, позволяющим отслеживать увеличение камер сердца при динамическом наблюдении, является индекс сферичности. Индекс сферичности рассчитывается по четырехкамерному изображению сердца в диастолу и является отношением продольного размера полости ЛЖ (от верхушки сердца до линии клапанного кольца) к максимальному поперечному размеру в средней трети левого желудочка. В норме индекс сферичности составляет 1,8-1,6. Снижение этого показателя в динамике до 1,5 и ниже свидетельствует о прогрессирующей дилатации левого желудочка.
При воспалительном поражении миокарда в 10-20% случаев на ЭхоКГ выявляется сопутствующий перикардит в виде сепарации листов перикарда. В 15-30% случаев у больных миокардитом снижается систолическая функция ЛЖ (фракция выброса), а изменение диастолической функции ЛЖ выявляется у 35-50% пациентов. Нарушение диастолической функции левого желудочка диагностируется по кривой трансмитрального кровотока при проведении ЭхоКГ.
Рентгенография
Рентгенологическое исследование позволяет подтвердить наличие кардиомегалии и оценить состояние малого круга кровообращения. Достоверными рентгенологическими признаками кардиомегалии являются: увеличение поперечного размера сердечной тени до 15,5 см и более у мужчин и до 14,5 см и более у женщин; увеличение кардиоторакального индекса (отношения поперечного размера тени сердца к внутреннему поперечному размеру грудной клетки) до 50% и более. У большинства больных острым миокардитом рентгенологические признаки дилатации камер сердца на фоне эффективного лечения значительно уменьшаются или исчезают совсем.
У больных миокардитом с симптомами левожелудочковой недостаточности рентгенологически можно выявить признаки венозного застоя крови в легких: усиление легочного рисунка в верхних отделах легких за счет расширения мелких сосудов; расширение корней легких; горизонтальные линии Керли; выпот в плевральных синусах, чаще справа.
Морфометрические методы
Все изменения, выявленные при лабораторном и иммунологическом обследовании, на ЭКГ и ЭхоКГ, не являются специфичными признаками, характерными для миокардита. Для установления окончательного диагноза необходимо подтверждать воспаление и его последствия морфометрическими методами. К морфометрическим методам относятся: биопсия миокарда с последующим гистологическим изучением микропрепаратов; томосцинтиграфия сердца с «воспалительными» и кардиотропными радиофармпрепаратами; магнитно-резонансная томография сердца с контрастированием и ультразвуковая денситометрпя.
Эндомиокардиальная биопсия
Одним из методов диагностики воспалительного процесса в мышце сердца является эпдомиокарднальпая биопсия (ЭМБ). Показания к ЭМБ достаточно широки. Ее рекомендуют проводить при всех кардиомиопатиях для определения причин дилатации или гипертрофии сердца, а также при констриктивных и рестриктивных заболеваниях. Для морфологического подтверждения диагноза считается необходимым взять 3-7 биоптатов сердца. Основным морфологическим признаком воспаления является наличие клеточной инфильтрации, которая состоит из лимфоцитов, нейтрофилов, эозинофилов и гистиоцитов. Можно выявить отек межклеточного пространства, полнокровие сосудов микроциркуляторпого русла, набухание эндотелия, дистрофические изменения кардиомиоцитов и миокардитический кардиосклероз. Для морфологического подтверждения миокардита используют рекомендованные группой американских морфологов в 1986 г. - “далласские критерии” (таблица 29).
Таблица 29.Далласские критерии миокардита
| Диагноз миокардита | Гистологические признаки |
| Определенный миокардит | Воспалительная инфильтрация миокарда с некрозом и/или дегенерацией прилегающих миоцитов, не характерных для ИБС |
| Вероятный миокардит | Воспалительные инфильтраты достаточно редки либо кардиомиоциты инфильтрированы лейкоцитами. Нет участков миоцитонекроза. Миокардит не может быть диагностирован в отсутствие воспаления |
| Миокардит отсутствует | Нормальный миокард или имеются патологические изменения ткани невоспалительной природы |
При первичной эндомиокардиалыюй биопсии различают: активный миокардит с фиброзом или без фиброза; пограничный миокардит с фиброзом или без фиброза (в этом случае возможна повторная биопсия); отсутствие миокардита. При повторной эндомиокардиальной биопсии: продолжающийся миокардит с фиброзом или без фиброза; разрешающийся миокардит с фиброзом или без него; разрешившийся миокардит с фиброзом или без него. Количественные морфометрические критерии активного миокардита заключаются в присутствии 14 лимфоцитов и более в поле зрения (при увеличении микроскопа в 400 раз), пограничного - от 5 до 14 клеток воспаления в поле зрения, при отсутствии миокардита - в поле зрения находят менее 5 клеток.
В соответствии с Марбургским соглашением Комитета экспертов ВОЗ (1997) Далласские критерии были уточнены и дополнены. Рекомендовано выделять активный миокардит с фиброзом или без фиброза, хронический миокардит с фиброзом или без фиброза и отсутствие миокардита. Отличия новых (Марбургских) морфологических критериев от Далласских заключается в следующем: 1) оценка гистологического препарата проводится не в одном поле зрения, а на площади 1 мм2; 2) количество клеток воспаления при активном миокардите должно быть не менее 14, но не в поле зрения, а на площади 1 мм2; 3) при хроническом миокардите рекомендовано иммупогистохимическое выявление специфических Т-лимфоцитов ( CD 45) в мышце сердца, которые являются признаком хронического воспаления.
Окончательный, достоверный диагноз миокардита может быть установлен только по результатам гистологического исследования биоптата, полученного с помощью прижизненной эндомиокардиальной биопсии. Морфологическое изучение биоптатов позволяет, прежде всего, дифференцировать миокардит тяжелого течения и ДКМП, имеющие много общих клинических черт (кардиомегалия, прогрессирующая сердечная недостаточность).
В заключении морфолога должны быть указаны объемные площади межклеточного вещества, фиброза, кардиомиоцитов и количество клеток воспаления в микропрепарате (в поле зрения или на площади 1 мм3). Следует учесть, что ЭМБ не дает полной гарантии постановки диагноза, поскольку достаточно высока вероятность забора неизмененной ткани и получения ложноотрицательиого результата. Опыт многих авторов показал, что ЭМБ подтверждает клинический диагноз миокардита только в 17-50% случаев.
Вместе с тем, результаты гистологического исследования эндомиокардиальных биоптатов отличаются большой вариабельностью. Ложноотрицательные результаты прижизненной биопсии могут быть связаны с очаговым характером воспаления, когда кусочек ткани взят из интактного участка миокарда. Поэтому, чтобы получить достоверные результаты, необходимо исследование до 10 биоптатов из различных участков миокарда ЛЖ и ПЖ. На морфологическую картину оказывает выраженное влияние активное противовоспалительное лечение больных миокардитом.
Наличие морфологических признаков воспалительного процесса в миокарде действительно дает возможность подтвердить диагноз миокардита. Отсутствие этих признаков не является достаточным основанием для пересмотра этого диагноза. В клинических условиях показанием для прижизненной эндомиокардиальной биопсии может служить крайне тяжелое течение заболевания, рефрактерное к медикаментозной терапии. Когда возникает проблема дифференциальной диагностики между тяжелым диффузным миокардитом и ДКМП и решается вопрос о трансплантации сердца.
Сцинтиграфия
Для определения наличия лейкоцитарной инфильтрации в миокарде и выраженности перфузионпых нарушений, в клинической практике используется томосцинтиграфия сердца с различными радиофармпрепаратами (РФП). Для визуализации воспаления используют радиофармпрепараты, избирательно накапливающиеся в зоне воспаления: цитрат галлия-67 (67Ga ); аутолейкоциты, меченные технецием-99 или иидием-111-оксимом (111In ) и антитела к миозину.
Использование однофотошюй эмиссионной компьютерной томографии сердца (ОФЭКТ) позволяет получать качественные многомерные изображения миокарда с толщиной каждого томографического скана до 0,88 см. Таким образом, при анализе серии компьютерных срезов сердца можно определить наличие и протяженность лейкоцитарной инфильтрации в миокарде. Помимо определения воспаления в миокарде необходимо проведение повторной томосцинтиграфии с перфузиопными РФП.
Для этого используют такие РФП, как99Тс-технетрил (или99Тс-М1В1) и излучающие нуклиды таллия хлорида-201 (201Т1). Перфузионный РФП накапливается в иптактной ткани сердечной мышцы, оставляя участки ишемии, некроза и кардиосклероза в виде «дефектов накопления». В диагностике стенозирующего атеросклероза коронарных артерий необходимо проведение нагрузочных проб (велоэргометрия, тредмил, пробы с дофамином или дипиридамолом) и на высоте нагрузки, когда создаются условия несоответствия доставки кислорода в ткани и его повышенным потреблением, вводят перфузионный РФП, а затем проводят сцинтиграфию миокарда. Сцинтиграфия сердца используется для оценки микроциркуляторного русла, а нарушение микроциркуляции при сохранении магистрального кровотока по венечным артериям чаще всего связано с миокардитическим кардиосклерозом. Проведение радиоизотопной диагностики в комплексе из двух исследований (определение воспалительной инфильтрации, перфузии миокарда) позволяет оценить наличие воспалительной инфильтрации в миокарде, определить нарушение перфузии. Это связано с миокардитическим кардиосклерозом.
Магнитно-резонансная томография
Воспалительную инфильтрацию в миокарде можно выявить посредством магнитно-резонансной томографии (МРТ) с контрастированием парамагнитными контрастирующими препаратами. Метод МРТ позволяет визуализировать участки внеклеточной воды, характерных для отека миокарда. Для определения воспаления в миокарде сначала необходимо выполнить первичную МРТ сердца, затем внутривенно ввести парамагнитный контраст и через 10-30 минут провести повторное магнитно-резонансное исследование. Контраст избирательно накапливается в участках внеклеточной воды и изменяет резонансные свойства тканей. По серии изображений миокарда до и после контрастирования можно судить о локализации и протяженности воспалительной инфильтрации в миокарде.
Ультразвуковая денситометрия миокарда
Самым доступным в кардиологической практике является эхокардиография, которая позволяет оцепить размеры камер сердца, толщину стенок, состояние клапанного аппарата, глобальную и локальную сократительную способность миокарда. Использование режима « acoustic densitometry » позволяет определить плотность миокарда и сделать заключение о наличии отека и фиброза в сердечной мышце. Средние значения плотности миокарда в диастолу в норме составляют 11 ед. (9-13 ед.).
При отеке миокарда Эхо-плотность сердечной мышцы снижается, а при фиброзе - повышается. Второй показатель, позволяющий судить о наличии отека и фиброза в миокарде - расчетный коэффициент соотношения плотности миокарда в диастолу и в систолу (систоло-диастолическое соотношение - СДС). Это процентное соотношение Эхо-плотности миокарда в конце диастолы и конце систолы. В норме показатель СДС составляет от +30 до +45%, у больных с отеком в миокарде (гипотиреоз, миокардит) систоло-диастолическое соотношение снижается от +5 до +10%, а у больных с фиброзом в миокарде (системная склеродермия, кардиосклероз) оно приобретает отрицательное значение от -19 до -31%.
Диагностическимй алгоритм при миокардите
Несмотря на множество клинических симптомов заболевания, изменений лабораторных и инструментальных показателей, диагноз миокардита устанавливается после тщательного анализа результатов обследования, при этом существенное значение имеют опорные клинико-инструментальные критерии заболевания. Для первичной клинической диагностики целесообразно использовать диагностические алгоритмы, которые позволяют заподозрить у больного миокардит. В дальнейшем воспалительную инфильтрацию и кардиосклероз необходимо подтверждать морфометрическими методами. Наиболее известна схема клинико-инструментальной диагностики миокардита, рекомендованная Нью-Йоркской ассоциацией кардиологов ( NYHA , 1973) (таблица 30).

Таблица 30. Схема диагностики миокрадитов (NYHA , 1973)
По критериям NYHA (1973) появлению симптомов поражения сердца должна предшествовать инфекция. Это обязательный признак, который должен доказан клиническими данными и лабораторными методами. Кроме инфекционного фактора у больных должны быть клинические и лабораторные признаки воспаления, синдромы поражения миокарда, которые разделены на «большие» и «малые» диагностические критерии. Диагноз миокардита наиболее обоснован, если после перенесенной инфекции (доказанной лабораторно и клинически), через 2-3 недели, выявляются 2-3 «больших» и 1-2 «малых» критерия.
Позднее к большим критериям заболевания был добавлен еще один синдром - изменение иммунологических показателей. Перечисленные критерии не охватывают ни жалоб больных, ни клинических симптомов заболевания, а лишь констатируют изменения лабораторно-инструментальных показателей в связи с инфекционным заболеванием. Все клинико-лабораторные и инструментальные критерии, представленные диагностическом алгоритме, являются косвенными и встречаются при других заболеваниях сердечно-сосудистой системы. По набору вышеуказанных признаков невозможно судить о наличии и протяженности воспалительной инфильтрации и миокардитического кардиосклероза.
Для жиагностики миокардита необходимо придерживаться современного алгоритма, который включает: оценку жалоб больных и данных объективного обследования; изучение лабораторных и иммунологических показателей, характерных для повреждения кардиомиоцитов и воспалительного процесса; выявление электрической и механической дисфункции сердца; выявление признаков ХСН; визуализацию воспалительной инфильтрации в миокарде и выраженности миокардитического кардиосклероза; выявление инфекционных патогенов.
КРИТЕРИИ ДИАГНОСТИКИ
Достоверная диагностика заболевания представляет собой одну из наиболее сложных задач современной клинической кардиологии. В случае возникновения острого диффузного миокардита особое внимание следует уделять связи внезапно появившихся кардиальных симптомов с предшествующими эпизодами респираторных, вирусных и бактериальных инфекций, а также с аллергическими реакциями, контактом с токсическими веществами.
Важным диагностическим признаком миокардита является наличие признаков воспалительного синдрома (субфебрилитет, увеличение СОЭ, лейкоцитоз, фибриногенемия, С-реактивный протеин, серомукоид), сохраняющегося после купирования инфекционного заболевания, аллергических реакций или воздействия на организм токсических веществ. В этих случаях диагноз может основыван на рекомендациях Нью-Йоркской кардиологической ассоциации (1998). Для диагностики острого диффузного миокардита используют 2 группы диагностических критериев - “больших” и “малых” симптомов (таблица 31).
Таблица 31. Диагностические критерии острого миокардита (NYHA, 1998)
| “Большие” критерии | “Малые” критерии |
| Хронологическая связь перенесенной инфекции (аллергической реакции, токсического воздействия) с появлением следующих кардиальных симптомов: | 1.Лабораторное подтверждение перенесенной инфекции (высокие титры противовирусных антител) |
| 1. Кардиомегалия 2. СН 3. Кардиогенный шок 4. Синдром Морганьи-Адамса-Стокса 5. Патологические изменения на ЭКГ, в том числе сердечные аритмии 6. Повышение активности кардиоспецифических ферментов (МВ-КФК, тропонин Т) | 2.Ослабление I тона 3.Протодиастолический ритм галопа |
Результаты эндомиокардиальной биопсии могут подтвердить воспалительные изменения миокарда, а иммунологические исследования - продемонстрировать высокие титры противокардиальных антител. Сложнее обстоит дело с диагностикой хронического диффузного миокардита, при котором часто не прослеживается связь с инфекционным заболеванием или другими этиологическими факторами и “большие” критерии теряют свое диагносическое значение. В этих случаях в диагностике может помочь определение высоких титров противокардиальных антител, других нарушений клеточного, гуморального иммунитета; лабораторное подтверждение наличия воспалительного синдрома (субфебрилитет, увеличение СОЭ, лейкоцитоз, фибриногенемия, С-реактивный протеин, серомукоид), повышение активности кардиоспецифических ферментов; результаты прижизненной пункционной биопсии миокарда.
Еще более трудной является диагностика малосимптомного или бессимптомного вариантов острого миокардита. В этих случаях нередко единственным симптомом, указывающим на возможное наличие воспалительного поражения миокарда, является отрицательная динамика ЭКГ (смещение сегмента RS-Т и/или изменения зубца Т) или появление нарушений АВ-проводимости. Связь этих изменений с перенесенной инфекцией или другими этиологическими факторами делает возможным лишь предположительный диагноз острого миокардита. В связи со значительным полиморфизмом симптомов острого или хронического миокардита, диагноз этого заболевания нередко приходится дифференцировать с ДКМП и острым ИМ.
Необходимость дифференциального диагноза с ДКМП возникает в случае тяжелого течения миокардита, выраженной кардиомегалии и прогрессирования признаков сердечной недостаточности. Основным диагностическим критерием миокардита является связь кардиомегалии и других клинических проявлений сердечной недостаточности с перенесенной инфекцией или другими этиологическими факторами воспаления сердечной мышцы. Однако при затяжном и хроническом течении заболевания такую связь в большинстве случаев установить не удается. В этих случаях наиболее достоверное подтверждение диагноза может быть получено при гистологическом исследовании биоптатов и обнаружении клеточных воспалительных инфильтратов и повреждения кардиомиоцитов неишемического происхождения.
Воспалительние миокарда можно предположить на основании следующих клинических данных: указания на перенесенный в прошлом инфекционный или инфекционно-токсический миокардит; результаты лабораторного исследования (стойкое ускорение СОЭ, повышение показателя С-реактивного белка, гипергаммаглобулинемия, возрастание активности кардиоспецифических ферментов, высокие титры противокардиальных антител); поражение других органов и систем у больных с аутоиммунным характером заболевания (длительная лихорадка или стойкий субфебрилитет, наличие суставного синдрома. признаки полисерозита, гепато- и спленомегалия, увеличение лимфатических узлов).
Необходимость дифференцирования миокардита с инфарктом миокарда возникает в тех случаях, когда имеется псевдокоронарный клинический вариант миокардита, который проявляется длительными интенсивными болями в области сердца; инфарктоподобными изменениями ЭКГ (патологический зубец Q или комплекс QS, смещение сегмента RS-Т и изменения зубца Т); увеличением активности кардиоспецифических ферментов (МВ-КФК, тропонин Т).
Для миокардита характерен чрезвычайно длительный болевой синдром. Боли не связаны с физической нагрузкой и не купируются нитроглицерином. Изменения комплекса QRS при миокардите не претерпевают характерной для острого ИМ динамики. Изменения ЭКГ не соответствуют тяжести клинической картины, выраженности кардиомегалии и СН. Гиперферментемия при миокардите выражена в меньшей степени, чем при остром ИМ. Важным дифференциально-диагностическим признаком миокардита является связь кардиальной симптоматики с перенесенной инфекцией, аллергией, токсическим воздействием.
Клиническая картина миокардита неспецифична, диагностика заболевания в ряде случаев представляет определенную сложность и сопряжена с большим количеством ошибок. Поэтому при воспалительных поражениях миокарда важное значение имеет дифференциальный диагноз.
Для исключения методических ошибок при проведении обследования, необходимо строго придерживаться современного диагностического алгоритма. Он включает: выявление неспецифических признаков воспалительного поражения миокарда и хронической сердечной недостаточности по данным объективней о обследования; выполнение рентгенографии грудной клетки, ЭКГ, суточного мониторирования ЭКГ, ЭХОКГ; изучение лабораторных и иммунологических показателей, характерных для воспалительного процесса и поражения кардиомиоцитов; верификацию воспалительной инфильтрации в миокарде и кардиосклероза посредством морфометрических методик; поиск очагов хронической инфекции, инфекционных антигенов и антител к ним.
Дифференциальная диагностика должна проводиться постоянно, круг синдромосходной патологии не должен ограничиваться только заболеваниями сердца. Обязательно следует проводить обследование щитовидной железы для исключения тиреоидита, тиреотоксикоза или гипотиреоза. Всем больным необходимо проводить ультразвуковое исследование железы, а при необходимости - определять концентрацию тироксина, трийодтиронина, тиреотропного гормона и антител к тиреоглобулину.
У лиц молодого возраста (14-35 лет) всегда необходимо исключать ревматизм, ревматические пороки сердца и соединительнотканные дисплазии сердца. В диагностике помогают тщательный сбор анамнеза заболевания, внимательный осмотр костно-суставного аппарата, выявление критериев и синдромов ревматизма, определение концентрации антистрептолизина-О, а также подтверждение патологии клапанного аппарата и наличия малых аномалий сердца при ЭХОКГ.
У больных средней возрастной группы (35-50 лет) в ходе дифференциальной диагностики необходимо исключать гипертоническую болезнь, симптоматические гипертензии и ишемическую болезнь сердца, для чего следует проводить суточное мониторирование артериального давления, нагрузочные ЭКГ-пробы, а при необходимости - исследовать коронарные артерии сердца.
Кардиалгии, одышка, перебои в работе сердца и другие жалобы и изменения па ЭКГ могут быть и у больных с анемией, уремией, алкогольным поражением сердца, хроническим тонзиллитом и дисфункцией вегетативной нервной системы. Любой патологический процесс как инфекционной, так и не инфекционной природы может сопровождаться дистрофическими изменениями в клетках сердца. При проведении дифференциальной диагностики миокардита и дистрофии миокарда помогают следующие клинико-инструментальные показатели: быстрое купирование клинических признаков и нарушений ритма после устранения причин, вызвавших дистрофические изменения кардиомиоцитов и курса метаболической терапии, отсутствие в крови кардиального антигена и антител к миокарду; нормальные значения концентрации фактора некроза опухоли-ос; отсутствие дилатации камер сердца и систолической дисфункции; отсутствие воспалительной инфильтрации и миокардитического кардиосклероза.
После перенесенного миокардита у боль
Лечение Миокардит:
ЛЕЧЕНИЕ ОСТРОГО МИОКАРДИТА
Малосимптомные формы острого миокардита не требуют специфического лечения. В этих случаях бывает достаточно ограничения физической активности, дезинтоксикационной, общеукрепляющей терапии. При необходимости применяют антигистаминные лекарственные средства. Антибиотики при отсутствии специальных показаний не назначают при аллергических реакциях и аутоиммунных нарушениях, потому что их применение в этих случаях может нанести вред. Необходим контроль за динамикой ЭКГ и гемодинамических показателей (повторные ЭКГ, ЭхоКГ).
Лечение острого миокардита тяжелого течения с признаками кардиомегалии, застойной сердечной недостаточности и выраженными аутоиммунными нарушениями вызывает большие трудности. В этих случаях лечение должно быть направлено на коррекцию гемодинамических нарушений, терапию основного заболевания, коррекцию иммунного статуса и иммунопатологических реакций, лечение и профилактику аритмий и тромбоэмболических осложнений.
Лечение СН должно предусматривать: ограничение физической активности, в тяжелых случаях назначение постельного режима; ограничение потребления поваренной соли до 2-3 г в сутки; ограничение потребления жидкости до 1-1,2 л в сутки; назначение калиево-магниевой диеты. Медикаментозное лечение проводится согласно общим принципам лечения этого патологического синдрома.
В комплекс терапии СН обычно включают диуретики, ингибиторы АПФ, сердечные гликозиды. Прием сердечных гликозидов обязательно сочетают с ингибиторами АПФ в малых суточных дозах, оказывающими не только положительное влияние на гемодинамические параметры, но и обладающими противовоспалительными свойствами. При наличии гипокалиемии, способствующей развитию гликозидной интоксикации, следует назначить препараты калия в сочетании с калийсберегающими диуретиками - антагонистами альдостерона (верошпирон). При застойных явлениях в легких показаны также периферические вазодилататоры, осуществляющие гемодинамическую разгрузку сердца (снижение преднагрузки и постнагрузки). С этой целью назначаются препараты изосорбид-динитрата или изосорбид-5-мононитратa. Для купирования острой левожелудочковой недостаточности внутривенно капельно вводят раствор натрия нитропруссида, нитроглицерина или изокета.
При лечении острого миокардита применяют различные группы лекарственных препаратов, обладающих противовоспалительными, десенсибилизирующими свойствами. Их назначение способствует уменьшению проницаемости сосудистой стенки, стабилизации лизосомальных мембран, снижению титров противокардиальных антител, подавлению возможных аллергических реакций замедленного типа. Чаще используют препараты аминохинолинового ряда (делагил, резохин, хлорохин). Их назначают в суточной дозе 0,25-0,5 г. Возможно применение плаквинила (0,4 г в сутки). Эти препараты применяют для лечения миокардита в течение 6-9 месяцев, а при рецидивирующем течении - до 1 года. Ацетилсалициловую кислоту назначают в дозе до 3 г в сутки в течение 4-5 недель. Индометацин применяют в дозе 75-100 мг в сутки в течение 4-6 недель, иногда в сочетании с хинолиновыми производными. Мовалис, диклофенак (вольтарен). Пиразолоновые производные (бутадион, бруфен, ибупрофен), хотя и применяются для лечения миокардитов, все же обладают малой эффективностью.
Хотя перечисленные нестероидные противовоспалительные препараты оказывают определенное влияние на клинические проявления заболевания (болевой синдром, лихорадку, динамику клинико-лабораторных показателей), убедительных доказательств их благоприятного действия на исходы миокардита до сих пор не получено. Антибактериальная терапия показана в случаях распространенной бактериальной инфекции, на фоне которой развивается миокардит, при ИЭ или сепсисе, осложненных бактериальным миокардитом. Эффективность применения противовирусных препаратов (рекомбинантного α-интерферона, рибаверина) при вирусных миокардитах в настоящее время изучается.
Глюкокортикоиды в течение последних 10-15 лет достаточно широко используется для лечения миокардитов. Хотя применение этих препаратов при иммунном воспалении сердечной мышцы теоретически вполне обосновано, многие исследователи весьма негативно оценивают перспективу их использования при острых миокардитах. В настоящее время получены убедительные экспериментальные данные, свидетельствующие о том, что использование глюкокортикоидов в ранней стадии вирусного миокардита приводит к усилению поражения сердца и увеличению смертности экспериментальных животных.
При сравнении результатов различных способов консервативного лечения больных миокардитом, осложненным СН II-IV ФК (по NYHA), выявлено, что подключение к стандартной терапии (сердечные гликозиды, эналаприл, диуретики) иммуносупрессантов (глюкокортикоидов с азатиоприном, циклоспорином) сопровождается более выраженным ухудшением гемодинамических показателей. Эти данные свидетельствуют о том, что назначение глюкокортикоидов, иммуносупрессантов должно быть избирательным дифференцированным.
Глюкокортикоиды целесообразно использовать при хронических и рецидивирующих формах миокардита, в генезе которых большее значение приобретают аутоиммунные механизмы: при тяжелых миокардитах, протекающих с выраженным аллергическим компонентом или иммунными нарушениями; при миокардитах затяжного и рецидивирующего течения; при миокардитах, сопровождающихся перикардитом (миоперикардитах); возможно, при миокардитах, протекающих с выраженным болевым синдромом. Целесообразно также назначение глюкокортикоидов при тяжелом гигантоклеточном миокардите, а также у больных СПИДом. В этих случаях преднизолон назначают обычно в дозе 0,4-0,75 мг/кг массы тела в сутки. Длительность приема составляет 1,5-2 месяца с постепенным снижением дозы и отменой препарата.
Гепарин назначают при тяжелых формах острого миокардита с выраженной клиническо-лабораторной активностью. В этих случаях гепарин способствует профилактике тромбоэмболических осложнений, снижает активность лизосомальных ферментов, угнетает перекисное окисление липидов (ПОЛ), уменьшает сосудистую проницаемость, стимулирует иммунитет. Гепарин назначают в дозе 5000-10 000 ЕД 4 раза в день подкожно в течение 7 дней. Затем снижают дозировку, продолжая инъекции до 10-14 дней. В последующем назначают непрямые антикоагулянты или антиагреганты.
Метаболические препараты также традиционно используют при острых миокардитах. В остром периоде заболевания целесообразно использовать внутривенное капельное введение глюкозо-инсулино-калиевой смеси. В дальнейшем показан прием триметазидина (предуктала). Хотя влияние этого препарата на исходы миокардитов пока детально не изучено, положительные результаты его использования у больных ИБС и ХСН, а также отсутствие побочных явлений, делают вполне обоснованным его применение при миокардитах, протекающих с дисфункцией ЛЖ. В то же время эффективность традиционно используемых в кардиологической практике кокарбоксилазы, рибоксина и других ЛС вызывает сомнение
Прогноз заболевания зависит от распространенности поражения сердечной мышцы и особенностей воспалительного процесса в миокарде, наличия дисфункции ЛЖ и тяжести течения заболевания, на фоне которого развивается миокардит. В большинстве случаев имеется латентное малосимптомное течение миокардита, которое обычно заканчивается полным клиническим выздоровлением в течение нескольких недель. Даже в тех случаях, когда миокардит осложняется сердечной недостаточностью, на фоне адекватной терапии происходит уменьшение или исчезновение этих явлений.
В тяжелых случаях течение острого миокардита осложняется быстропрогрессирующей СН, желудочковой аритмией высоких градаций и/или возникновением внезапной смерти. Особенно тяжело протекают гигантоклеточный миокардит (смертность 100% при консервативной терапии), дифтерийный миокардит (смертность 50-60%), миокардит при болезни Чагаса (американском трипаносомозе) В этих случаях средством выбора становится трансплантация сердца, существенно улучшающая прогноз заболевания при этих формах миокардита. При малосимптомных очаговых миокардитах, не сопровождающихся выраженной дисфункцией ЛЖ, возможно развитие фибрилляции или асистолии желудочков.
ЛЕЧЕНИЕ ХРОНИЧЕСКОГО МИОКАРДИТА
Последовательность назначения медикаментов
В план лечения должны быть включены этиотропные (антибиотики и противовирусные препараты), противовоспалительные, антигистаминные, антиаритмические, метаболические средства, антикоагулянты, (b-адреноблокаторы, ингибиторы АПФ, антагонисты альдостерона, диуретики. На каждом этапе терапии необходимо выбирать главное направление лечения.
На первоначальном этапе лечения миокардита необходимо сосредоточить все усилия на проведении этиотропной, антикоагулянтной и метаболической терапии. Метаболическая терапия должна начинаться до антибактериальной и противовирусной терапии, так как введение этиотропных средств может вызвать ухудшение состояния, что выражается в увеличении функционального класса хронической сердечной недостаточности и тяжести нарушений ритма. Ухудшение состояния больных на фоне этиотропной терапии связано, с одной стороны, с эндогенной интоксикацией, вследствие разрушения микробных клеток и вирусов, а с другой - с токсическим действием этиотропных средств на поврежденные кардиомиоциты. Минимизировать побочное действие антибиотиков и противовирусных средств позволяет цитопротективная терапия.
После окончания этиотропного лечения необходимо провести курс противовоспалительной, антиоксидантной терапии и вакцинопрофилактику. Помимо курсового лечения назначаются препараты, которые больной принимает постоянно и длительное время, а другие - только по показаниям. К препаратам, назначаемым для постоянного приема, относят ингибиторы АПФ, b-адреноблокаторы, антагонисты альдостерона. По строгим показаниям назначаются антиаритмические средства, диуретики и стероидные противовоспалительные препараты (группа преднизолона).
Через 5-6 месяцев целесообразно оценить первые результаты лечения, для чего необходимо посмотреть в динамике концентрацию кардиоселективных ферментов, биохимических маркеров воспаления, кардиального антигена, антител к миокарду, оценить размеры камер сердца и систолическую функцию миокарда по данным ЭхоКГ, выраженность нарушений ритма и проводимости с помощью ЭКГ-мониторирования. При необходимости целесообразно выполнить ультразвуковую денситометрию миокарда или повторную сцинтиграфию сердца с «воспалительным» и кардиотропным радиофармпрепаратами.
Лучше контрольное обследование проводить стационарно, так как по его итогам выносится заключение о профессиональной пригодности пациента. В медицинском заключении необходимо указать вариант течения заболевания (доброкачественное, прогрессирующее или рецидивирующее), выраженность нарушений ритма и ХСН. Особое внимание следует обратить не только на клиническое течение заболевания, но и на наиболее важные лабораторные показатели: на концентрацию кардиального антигена, антител к миокарду и фактора некроза опухоли. Увеличение вышеуказанных показателей более чем в 4 раза свидетельствует о прогрессировании миокардита с выраженной аутоиммунной перестройкой. При таком варианте течения заболевания необходимо провести повторное лечение с акцентом на иммунокорригирующую терапию (лечебный плазмаферез, индукторы интерферона, стероидные противовоспалительные средства).
Если за время наблюдения у больного возрастают проявления ХСН, прогрессируют нарушения ритма на фоне респираторного вирусного заболевания, переохлаждения, физического или выраженного психоэмоционального стресса, можно полагать о рецидивирующем течении воспалительного процесса миокарде. В этом случае показан повторный курс противовирусной и метаболической терапии.
В некоторых случаях течение воспалительного процесса в миокарде сопровождается упорными и длительными кардиалгиями в покое в вечернее и ночное время. При этом на фоне нагрузки боли в области сердца практически не беспокоят, нет и изменений на ЭКГ при нагрузочных пробах. Такой характер болевого синдрома в основном связан с ишемией, возникающей вследствие изменения (замедления) микроциркуляторного кровотока в миокарде во время отдыха. Для лечения подобных проявлений целесообразно повторить курс терапии сулодексидом, обладающим антитромботическим, фибринолитическим и ангиопротективным действием.
Контрольное обследование проводится через 12-16 месяцев после начала лечения, во время которого определяется характер течения заболевания, и при необходимости вырабатывается дальнейшая тактика терапии. Предложенная выше схема лечебных мероприятий имеет рекомендательный характер, поскольку окончательное решение по поводу конкретного больного всегда принимает лечащий врач. Однако, следует заметить, что данный алгоритм лечения является результатом анализа как позитивного, так и негативного собственного опыта, который считаем целесообразным донести до сведения практикующих врачей.
Течение хронического миокардита сопряжено с наличием хронической системной внутриклеточной инфекции и с аутоиммунными изменениями. Поэтому в комплексной терапии используют противовирусные препараты, экзогенные интерфероны, индукторы интерферонов, средства вакцинотерапии и вакцинопрофилактики, активная цитопротективная терапия (оптимизация энергопродукции, антиоксидантные средства).
При использовании антибиотиков, НПВС, средств метаболической и симптоматической терапии синдром Яриша-Герксгеймера (Я-Г) встречался в 12% случаев, а прогрессирование заболевания и рецидивы миокардита отмечались у 63% пациентов. Где проводилась кроме того и иммуномодулирующая терапия, осуществлялась вакцинопрофилактика, синдром Яриша-Герксгеймера встречался в 78% случаев, но прогрессирование и рецидивы были отмечены у 27% больных. Где проводилась терапия в полном объеме, включая и цитопротективную, синдром Яриша-Герксгеймера встречался в 26% случаев, а прогрессирование заболевания и рецидивы миокардита отмечались только у 25%.
Для достижения хорошего отдаленного эффекта лечение должно включать санацию очагов хронической инфекции, повторные курсы антибактериальной и противовирусной терапии, назначение противовоспалительных и метаболических средств, индукторов интерферона (b-адреноблокаторов, ингибиторов АПФ, антагонистов альдостерона, цитопротекторов). Наилучший эффект дает весь комплекс лечении, при этом синдром Яриша-Герксгеймера отмечается реже в 3 раза, а рецидивы заболевания в 2,4 раза, чем при не полном использовании арсенала лечебных мероприятий.
Антибактериальная и противовирусная терапия
Одной из основных причин хронизации воспаления при хроническом миокардите является участие в патологическом процессе внутриклеточных возбудителей: вирусов Коксаки, вирусов простого герпеса 1 и 2 типов, вирусов Эпштейна-Барра, цитомегаловирусов, аденовирусов, хламидий, токсоплазмы. Внутриклеточный характер существования микроорганизмов существенно затрудняет полную санацию организма. При этом длительное персистирование возбудителей с постоянным повреждением кардиомиоцитов создает все необходимые условия для вторичного иммунодефицитного состояния и перекрестных аутоиммунных реакций.
В 40-80% случаев миокардит протекает на фоне хронической очаговой инфекции. Основными клиническими формами хронической очаговой инфекции являются хронический тонзиллит, периапикальные зубные гранулемы, пародонтоз, хронический синусит, холецистит, аднексит, простатит. Роль хронической инфекции как этиологического фактора миокардитов до конца не ясна, но несомненно, что постоянная интоксикация и сенсибилизация организма является неблагоприятным фоном для развития и прогрессирования миокардита.
Выраженность воспалительного процесса в миокарде определяется вирулентностью возбудителя и адекватностью иммунного ответа организма. Наиболее бурный воспалительный ответ вызывают внеклеточные возбудители (стрептококки, стафилококки, пневмококки). Однако эти возбудители легче поддаются воздействию на них антибиотиков, а также с меньшей вероятностью вызывают хронизацию процесса (за исключением стрептококков, имеющих уникальную антигенную структуру).
Этиотропное лечение миокардитов, вызванных внеклеточными бактериями (как правило, это острые миокардиты или дебют хронических миокардитов), в настоящее время не вызывает трудностей. Назначение антибиотиков, в первую очередь цефалоспоринов и макролидов, достаточно легко позволяет решить эту проблему. Наличие хронической внутриклеточной инфекции изменяет ход патологического процесса и определяет иной подход к этиотропной терапии. Поэтому необходимо прибегать к повторным курсам антибиотиков (макролиды, цефалоспорины 3 поколения, фторхинолоны), а также подавлять вирусную инфекцию иммуномодулирующими препаратами.
В качестве иммуномодулирующих препаратов, обладающих противовирусным действием, в острый период заболевания целесообразно использовать экзогенные интерфероны, индукторы эндогенного интерферона и противовирусные иммуноглобулины. Их применение целесообразно и при рецидивах хронического миокардита. При лечении больных хроническим миокардитом эффективен неовир (индуктор интерферона, оказывающий противовирусное и противохламидпйное действие), виферон (препарат человеческого рекомбинантного интерферона альфа-2.
В период реконвалесценции и ремиссии проводится курс профилактической вакцинотерапии препаратом ИРС-19. Профилактическая вакцинотерапия применяется с целью ознакомления иммунной системы больного человека с антигенами острых и хронических инфекций, что в долгосрочной перспективе позволяет снизить риск возникновения острых респираторных заболеваний. Применение экзогенных интерферонов и противовирусных иммуноглобулинов является отдельным (этиотропным) элементом терапии хронических миокардитов.
Противовоспалительная терапия
Подавление инфекции - это первый, но не единственный шаг на пути лечения хронического миокардита. Помимо инфекционных возбудителей прямое негативное влияние на миокард оказывают воспалительные и аутоиммунные процессы. При хронических миокардитах местные нейтрофильная и лимфоклеточная инфильтрации обусловлены повышенной сенсибилизацией лейкоцитов не столько к инфекционным патогенам, сколько к миокарду. Выраженность воспалительной реакции в миокарде, при таком течении заболевания, чаше всего бывает неадекватно велика, а главное неэффективна в плане элиминации возбудителя, но разрушительна для кардиомиоцитов.
В ходе длительных воспалительных и иммунных реакций в миокарде высвобождаются биологически активные вещества (простагландины, кинины, серотонин, гистамин), способствующие повреждению кардиомиоцитов вследствие местного отека, геморрагии и гипоксии, стимулирующие и поддерживающие фиброзирование в миокарде. Избыточные воспалительные и аутоиммунные реакции провоцируют прогрессию еще одной из патологических основ хронического миокардита - образование избыточного кардиосклероза. Поэтому помимо назначения антибактериальных и противовирусных средств необходимо проводить противовоспалительную и иммуномодулирующую терапию.
Нестероидные противовоспалительные средства достаточно широко применяются при лечении миокардитов. Назначать их следует коротким курсом на 2-3 недели в средних терапевтических дозах параллельно с проведением антибактериальной и противовирусной терапии. Оправдано назначение делагила, римикейда хорошо зарекомендовавших себя при лечении диффузных заболеваний соединительной ткани. Длительный прием делагила (до 4-6 месяцев) оказывает умеренно выраженное противовоспалительное и иммунодепрессивное действие.
Цель назначения антигистаминных средств - это уменьшение выраженности воспалительных реакций вследствие блокирования биологически активных веществ, снижение антигенной нагрузки на иммунную систему и угнетение аутоиммунных реакций. Препараты назначают на 3-4 недели в средних терапевтических дозах с последующей полной отменой.
Непростой вопрос терапии хронических миокардитов - это назначение стероидных противовоспалительных средств. Эти препараты целесообразно назначать в тех случаях, когда доказан выраженный аутоиммунный компонент воспаления (выявлены антитела к миокарду в больших титрах, значительно повышена концентрация ФНО-а), а также доказана повышенная сенсибилизация лимфоцитов к миокарду. Оправданное назначение стероидных противовоспалительных препаратов способствует быстрому купированию воспалительных и аутоиммунных реакций.
Преднизолон целесообразно назначать коротким курсом. Лучше применять препарат в виде пульстерапии (внутривенно через день 5 инъекций в дозе 3-5 мг/кг массы тела больного). Возможно назначение преднизолона внутрь (в дозе 0,5 мг/кг массы тела в течение 7-10 дней) с последующей отменой в течение месяца. Положительные клинические эффекты после назначения преднизолона отмечаются достаточно быстро. Уменьшаются отеки и одышка, несколько увеличивается фракция выброса, возможна стабилизация нарушений ритма и проводимости.
В качестве иммунокоррекции эффективны повторные сеансы плазмафереза, которые позволяют уменьшить концентрацию антител к миокарду и ФНО-а. Одновременно назначались повторные курсы индукторов интерферона и вакцинотерапии. Отмечен хороший эффект в течение 1-2 месяцев и в отдаленные сроки.
Цитопротективная терапия
Некроз кардиомиоцитов в период обострения хронических итокардитов может предотвращен посредством торможения деятельности инфекционных агентов, уменьшения выраженности воспалительных и аутоиммунных реакций. На период этиотропной, иммунокорригирующей и противовоспалительной терапии целесообразна госпитализация больного и соблюдение постельного режима. Помимо этого необходимо применение метаболической терапии, назначение b-адреноблокагоров, ингибиторов АПФ, антиоксидантов.
Патогенетическая оправданность метаболической терапии обусловлена облигатностью дистрофических процессов при любом патологическом процессе в миокарде, при этом, как уже говорилось, дистрофия может достигать крайней степени выраженности вплоть до гибели кардиомиоцитов. Дистрофия кардиомиоцитов признается всеми исследователями и практическими врачами как неизбежно присутствующий процесс при миокардитах, но редко получающий свою истинную патогенетическую и клиническую оценку. Поэтому оптимизация процессов образования и расхода энергии, нормализация баланса между интенсивностью свободнорадикального окисления и эффективностью антиоксидантной защиты должны быть обязательным компонентом терапии миокардитов. Данный вид лечебных мероприятий относится к метаболической терапии или «цитопротекции».
Для острой фазы воспалительного процесса характерно торможение аэробного гликолиза и аэробного бета-окисления СЖК, а также активация анаэробного гликолиза. В этот период времени необходима внутривенная инфузия глюкозо-инсулиновой смеси (исследования ECLA, DIGAMI), при этом очень желательно одновременное введение стимулятора окисления глюкозы. Последний доказал свою эффективность в исследовании CEDIM.
В клинической практике для метаболического лечения производятся замещение макроэргов (неотон, рибоксин) и стимуляция энергопродукции (мексикор). Препарат неотон является одной из самых оптимальных транспортных форм АТФ-КФ. После внутривенного введения неотона купируются проявления энергетического дефицита, так как проникая непосредственно в клетку, он способствует полноценному сокращению миофибрилл. Помимо восполнения энергетической задолженности плейотропные эффекты неотона связаны с прерыванием процессов анаэробного окисления жирных кислот, что в конечном итоге приводит к сохранению целостности клеточных мембран, с этим связан антиаритмический эффект препарата. Основным достоинством мексикора является его высокая антиоксидантная эффективность, выраженные свойства стимулятора энергопродукции.
Второе направление метаболической терапии заключается в оптимизации баланса между свободно-радикальным окислением и антиоксидантной защитой. При острых миокардитах свободно-радикальное окисление, направленное на уничтожение инфекционных агентов, является биологически оправданным процессом, поэтому тормозить его не стоит, несмотря на то, что выраженность окислительных реакций может быть даже несколько избыточной. При хроническом течении заболевания, на фоне постепенного истощения антиоксидантной защиты, избыточное свободно-радикальное окисление приобретает патологический характер, поэтому требует активной компенсации. В период обострений во время проведения активной антибактериальной терапии целесообразно назначение естественных антиоксидантов в больших дозах - витамин С (1 г/сутки), витамин Е.
Через 4-6 недель после этиотропной терапии показаны препараты, которые либо тормозят окисление жирных кислот (триметазид), либо инактивируют ферменты, ответственные за транспорт жирных кислот в митохондрию (этомоксир), либо ингибируют биосинтез самого переносчика жирных кислот через митохондриальные мембраны - карнитина (милдронат). Именно в это время угнетение транспорта жирных кислот оказывает положительное влияние на метаболизм клетки. Раннее назначение вышеуказанных препаратов при лечении миокардита целесообразно только в сочетании неотоном, потому что тормозя окисление жирных кислот до ацетилкоэнзима А при остром воспалительном процессе, эти препараты нарушают естественный метаболизм макроэргов на 60-80%.
Противосклеротическая терапия
Торможение прогрессирования миокардиосклероза должно осуществляться по трем основным направлениям: уменьшение количества погибающих кардиомиоцитов, снижение активности ренинангиотензин-альдостероновой и симпатоадреналовой систем, улучшение микроциркуляции. Соответственно для реализации первого направления необходимо проведение этиотропной, иммунокорригирующей, противовоспалительной, метаболической терапии, второго - назначение ингибиторов АПФ, антагонистов альдостерона, b-адреноблокаторов, а для реализации третьего необходимо назначение антитромботических средств (дезагрегантов, антикоагулянтов).
Этиотропная, иммунокорригирующая, противовоспалительная и метаболическая терапия проводятся по собственным показаниям, и какой-либо корректировки для профилактики развития кардиосклероза не проводится. Снижение активности ренин-ангиотензин-альдостероновой и симпатоадреналовой систем осуществляется с помощью ингибиторов АПФ и селективных бета-адреноблокаторов (метопролол). Самостоятельное значение в плане профилактики развития фиброзной ткани имеет антагонист альдостерона (верошпирон). Назначение ингибиторов АПФ, бета-адреноблокаторов и антагонистов альдостерона позволяет решать одновременно две задачи. Наиболее оптимальным является назначение на длительный срок малых доз ингибиторов АПФ: эналаприл по 5-10 мг в сутки, верошпирон по 25 мг в сутки.
Антитромботическая терапия в целях улучшения микроциркуляции должна начинаться уже в период проведения этиотропной терапии (в стационаре). Для этих целей целесообразно назначение инъекционных антикоагулянтов (фраксипарин, фрагмин, клексан). Антикоагулянты необходимо использовать достаточно долго (3-4 недели), а в дальнейшем больному рекомендовать постоянный прием пероральных антитромботических средств (аспирин). Весьма эффективным фармакологическим средством из группы гепариноидов для лечения больных хроническим миокардитом является сулодексид, который обладает антитромботическим, фибринолитическим и ангиопротективным действием.
Сулодексид способствует уменьшению вязкости крови вследствие снижения содержания фибриногена и тромбина в плазме и уменьшает адгезию тромбоцитов на сосудистой стенке, а дерматан сульфат, содержащийся в препарате активизирует фибринолиз. Препарат обладает высокой степенью тропизма к эндотелию сосудов и способен сорбироваться на его поверхности (до 90% от вводимой дозы), что объясняет его ангиопротективные свойства. Курс терапии сулодексидом рассчитан на 2-3 месяца, а в дальнейшем больному рекомендован длительный прием дезагрегантов.
Лечение сердечной недостаточности
В основе лечения сердечной недостаточности лежат современные классические принципы терапии ХСН, предполагающие использование ингибиторов АПФ, диуретиков, бета-адреноблокаторов и антагонистов альдостерона, при выраженной систолической дисфункции - сердечных гликозидов. Однако есть и некотрые особенности её проведения.
Первая касается той категории больных, у которых развитие ХСН обусловлено дебютом или рецидивом воспаления в миокарде. В большинстве случаев у этих больных быстрый регресс симптоматики сердечной недостаточноcти наблюдайся при назначении ингибиторов АПФ и диуретиков на фоне формирование фиброза миокарда. Также не исключен эффект омапатрилата, представляющего собой комбинацию ингибитора АПФ с ингибитором нейтральной эндопепгидазы, разрушающей натрийуретические пептиды.
Лечение ХСН, обусловленной диастолической дисфункцией, согласно рекомендациям Рабочей группы Европейского общества кардиологов по изучению диастолической сердечной недостаточности (1998) предполагает: коррекцию тахиаритмии (восстановление синусового ритма); назначение препаратов, замедляющих А-В проведение при тахикардии (бета-блокаторы, верапамил); применение нитратов (при ишемии миокарда); использование диуретиков (без выраженного снижения преднагрузки); назначение ингибиторов АПФ; применение сердечных гликозидов противопоказано (если нет снижения систолической функции). Наиболее отчетливый эффект лечения диастолической сердечной недостаточности у больных хроническим миокардитом достигался комбинацией ингибиторов АПФ с верошпироном. Такая терапия носит исключительно патогенетический характер и сочетает в себе свойства купирования симптоматики и предупреждения прогрессии развития диастолической и систолической дисфункций.
Лечение аритмий
Целенаправленному лечению подлежат атрио-ветрикулярная блокада с явлениями брадикардии, выраженная синусовая брадикардия, мерцательная аритмия, желудочковые нарушения сердечного ритма. АВ-блокада в основном наблюдается в дебюте или при рецидиве заболевания. В основе ее развития лежит воспаление и отек, а также выраженный вегетативный дисбаланс. Если блокада достигает II степени, могут назначаться холинолитики, а при необходимости возможна установка временного кардиостимулятора. Синусовая брадикардия и мерцательная аритмия развиваются, как правило, вследствие прогрессии кардиосклероза и наблюдаются уже в поздних стадиях заболевания.
В том случае если синусовая брадикардия начинает отчетливо способствовать прогрессии сердечной недостаточности, усугублению коронарной недостаточности на фоне имеющейся ИБС или появлению пресинкопальных или синкопальных состояний, таким больным показана имплантация постоянного ЭКС. Лечение мерцательной аритмии осуществляется по общим принципам и предполагает предупреждение пароксизмов, коррекцию частоты сердечных сокращений и профилактики тромбоэмболических осложнений.
Причиной появления желудочковых нарушений ритма (желудочковой экстрасистолии и желудочковой тахикардии) является дебют или рецидив воспаления миокарда. Поэтому назначение антибиотиков, иммунокорректоров и противовоспалительных препаратов является этиопатогенети-ческим способом лечения таких нарушений ритма у больных хроническим миокардитом. Гораздо сложнее обстоит дело с назначением собственно антиаритмиков этим больным.
Лечение аритмий при миокардитах необходимо проводить для уменьшения риска внезапной сердечной смерти. То есть, в случае наличия у больных миокардитом высокого риска внезапной смерти главная цель антиартмической терапии должна заключаться в профилактике пароксизмов устойчивой желудочковой тахикардии. Если осуществлять выбор антиаритмиков для профилактики пароксизмов устойчивой ЖТ с позиции классификации Вогана-Вильямса и критериев Сицилианского гамбита, то при ХСН коронарогенного происхождения это должны быть препараты III класса (амиодарон, соталол, добутилид), а при некоронарогенном происхождении ХСН - антиаритмики III и I класса (за исключением дизопирамида и флекаинида). При этом необходимо помнить, что если у больного сохраняется процесс воспаления в миокарде, то одновременно должны назначаться средства для его подавления.
Таким образом, лечение аритмий при хронических миокардитах должно иметь обоснованные показания. Безусловными показаниями для их назначения являются наличие желудочковой экстрасистолии высоких градаций и эпизодов желудочковой тахикардии у больных, выживших после предыдущей внезапной смерти, и у больных с рецидивирующими синкопэ неизвестного генеза, а также в случае подтверждения эпизодов устойчивой ЖТ. Наиболее эффективным и безопасным антиаритмиком для больных миокардитом является амиодарон.
При частой суправентрикулярной экстрасистолии, а также для удержания синусового ритма после купирования пароксизмов мерцательной аритмии целесообразно применение сотолола в средних терапевтических дозах. Назначение антиаритмических средств должно происходить на фоне активного подавления воспаления в миокарде.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
При проведении комплексной терапии у больных миокардитом практическому врачу необходимо отслеживать клинические, лабораторные и инструментальные показатели для того, чтобы сделать вывод о течении заболевания и вовремя скорректировать лечение. Для оценки выраженности воспалительной инфильтрации в миокарде можно использовать методы лучевой диагностики: томосцинтиграфию грудной клетки с мечеными99mТс-аутолейкоцитами, которая основана на феномене естественной миграции лейкоцитов в очаги воспаления, и магнитно-резонансную томографию сердца с контрастированием, позволяющую оценить выраженность внеклеточного отека. Оценить выраженность кардиосклероза позволяет перфузионная сцинтиграфия и эходенсинометрия. Эти диагностические процедуры могут быть рекомендованы к использованию в крупных медицинских стационарах, оснащенных соответствующей аппаратурой.
Для оценки результатов лечения практикующему врачу необходимо помнить, что улучшение состояния больного наступает достаточно быстро через 1-2 месяца от начала терапии. Однако воспалительная инфильтрация в миокарде, несмотря на нормализацию клинических и лабораторных показателей, может сохраняться весьма длительное время (6-12 месяцев) и сопровождается определенными иммунными нарушениями. Контрольную ОФ
Комментариев пока нет, поделитесь Вашим мнением - оно очень важно для нас.
